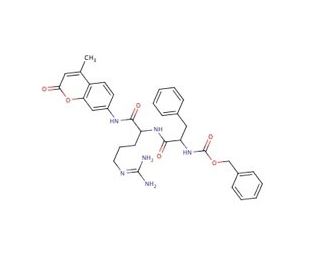
Cathepsin L substrate Substrat (CAS 65147-22-0)
Produktreferenzen ansehen (11)
Direktverknüpfungen
Der Kathepsin L Substrat ist ein spezialisiertes Molekül, das für die Verwendung in biochemischen Assays entwickelt wurde, um die proteolytische Aktivität von Kathepsin L zu untersuchen, einem Enzym, das an Proteinabbauprozessen beteiligt ist. In der Forschung sind diese Substrate von entscheidender Bedeutung, um die Mechanismen der lysosomalen Degradation und des Turnovers zu erhellen, sowie um die Spezifität und Kinetik des Enzyms zu verstehen. Wissenschaftler nutzen fluoreszierende oder chromogene markierte Substrate, um die Kathepsin L Aktivität in Echtzeit zu überwachen und so Einblicke in die Rolle dieses Enzyms in normalen zellulären Funktionen und in mit seiner Dysregulation assoziierten pathologischen Zuständen zu erhalten. Darüber hinaus sind diese Substrate von entscheidender Bedeutung bei der Screening von potenziellen Inhibitoren, die die Kathepsin L Aktivität modulieren können, ein Bereich, der für die Entwicklung von chemischen Proben von Interesse ist, die komplexe biologische Pfade aufschlüsseln. Die Entwicklung und Synthese solcher Substrate beinhaltet oft Peptidsequenzen, die von Kathepsin L erkannt und gespalten werden, was es Forschern ermöglicht, den Einfluss post-translationaler Modifikationen und das Verhalten des Enzyms unter verschiedenen experimentellen Bedingungen zu untersuchen.
Cathepsin L substrate Substrat (CAS 65147-22-0) Literaturhinweise
- Die Aktivität von Cathepsin S ist in menschlichen Keratinozyten nachweisbar und wird bei Stimulation mit Interferon-gamma selektiv hochreguliert. | Schwarz, G., et al. 2002. J Invest Dermatol. 119: 44-9. PMID: 12164923
- Charakterisierung von HC58cDNA, einer mutmaßlichen Cysteinprotease aus dem Parasiten Haemonchus contortus. | Muleke, CI., et al. 2006. J Vet Sci. 7: 249-55. PMID: 16871019
- Cathepsin B- und L-ähnliche Cysteinprotease-Aktivitäten während der In-vitro-Entwicklung von Hysterothylacium aduncum (Nematoda: Anisakidae), einem weltweiten Fischparasiten. | Malagón, D., et al. 2010. Parasitol Int. 59: 89-92. PMID: 19932193
- Die Cystein-Endoprotease-Aktivität des menschlichen ribosomalen Proteins S4 ist vollständig auf die C-terminale Domäne zurückzuführen und steht im Einklang mit dem Michaelis-Menten-Mechanismus. | Sudhamalla, B., et al. 2013. Biochim Biophys Acta. 1830: 5342-9. PMID: 23791938
- Apolipoprotein B-100 aus Plasmalipoproteinen niedriger Dichte wird durch Kontaktaktivierungsfaktoren proteolysiert, wenn das Plasma mit Dextransulfat-500-MgCl2 behandelt wird. | Byrne, RE. and Scanu, AM. 1989. J Lipid Res. 30: 109-20. PMID: 2465366
- Identifizierung von Cathepsin B aus dem großen gelben Krokodil (Pseudosciaena crocea) und seine Rolle bei der Verarbeitung der MHC-Klasse-II-assoziierten invarianten Kette. | Li, M., et al. 2014. Dev Comp Immunol. 45: 313-20. PMID: 24705226
- Zunehmende Expression und enzymatische Aktivität der Cysteinproteinase B während der In-vitro-Differenzierung von Leishmania (Viannia) braziliensis: Erster Nachweis einer Modulation während des morphologischen Übergangs. | Gomes, CB., et al. 2017. Biochimie. 133: 28-36. PMID: 27919786
- Identifizierung und Merkmale einer Cathepsin L-ähnlichen Cysteinprotease aus Clonorchis sinensis. | Ma, C., et al. 2019. Parasitol Res. 118: 829-835. PMID: 30689051
- Differentielle Spaltung spezifischer Substrate für Cathepsin-ähnliche Aktivität zeigt Cystein- und Serin-Protease-Aktivitäten und ein differentielles Profil zwischen Anisakis simplex s.s. und Anisakis pegreffii, Geschwister-Spezies Haupt-Ätiologie-Agenten der Anisakiasis. | Torralbo-Ramírez, V., et al. 2019. Foodborne Pathog Dis. 16: 744-751. PMID: 31215796
- Serinprotease-Profile von klinischen Isolaten von Leishmania (Viannia) braziliensis mit unterschiedlicher Empfindlichkeit gegenüber Antimon. | Zabala-Peñafiel, A., et al. 2021. Sci Rep. 11: 14234. PMID: 34244581
- Der lysosomale Enzym-Trafficking-Faktor LYSET ermöglicht die Verwertung extrazellulärer Proteine über die Nahrung. | Pechincha, C., et al. 2022. Science. 378: eabn5637. PMID: 36074822
- Sekretion von Cysteinproteinase-Aktivität durch den zoonotischen Hakenwurm Ancylostoma caninum. | Dowd, AJ., et al. 1994. Am J Trop Med Hyg. 51: 341-7. PMID: 7943555
- Cathepsin B von Schistosoma mansoni. Reinigung und Aktivierung des rekombinanten, von Saccharomyces cerevisiae sezernierten Proenzyms. | Lipps, G., et al. 1996. J Biol Chem. 271: 1717-25. PMID: 8576174
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Cathepsin L substrate, 5 mg | sc-3136A | 5 mg | $102.00 | |||
Cathepsin L substrate, 25 mg | sc-3136 | 25 mg | $265.00 | |||
Cathepsin L substrate, 100 mg | sc-3136B | 100 mg | $708.00 |
