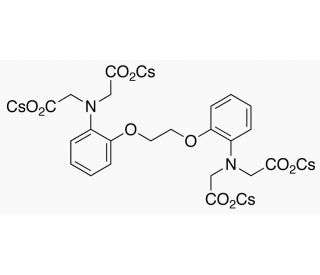
BAPTA-tetracesium Salt (CAS 480436-84-8)
Produktreferenzen ansehen (1)
Direktverknüpfungen
BAPTA-Tetracesiumsalz (BAPTA-TC) ist eine Verbindung, die aufgrund ihres breiten Anwendungsbereichs und ihrer Fähigkeit, sich effektiv an Calciumionen zu binden, in der wissenschaftlichen Forschung häufig verwendet wird. Abgeleitet von der Chemikalie BAPTA (1,2-Bis(2-Aminophenoxy)ethan-N,N,N',N'-Tetraessigsäure), die ursprünglich in den 1970er Jahren synthetisiert wurde, fungiert BAPTA-TC als Chelatbildner, der verwendet wird, um Calciumkonzentrationen in Zellen zu binden und zu modulieren. Die Vielseitigkeit von BAPTA-Tetracesiumsalz ist in seiner Verwendung für verschiedene Zwecke deutlich. Es ermöglicht die Modifizierung von zellulären Calciumkonzentrationen und erleichtert so die Untersuchung des Einflusses von Calcium auf zelluläre Prozesse. Darüber hinaus wurde es in Arzneimittelentwicklungsstudien eingesetzt, um die Wirkung von Arzneimitteln auf Zellen zu modulieren. BAPTA-Tetracesiumsalz hat sich auch als nützliches Werkzeug erwiesen, um den Einfluss von Calcium auf die neuronale Erregbarkeit, die Muskelkontraktion und intrazelluläre Signalwege zu untersuchen. Durch die Bindung an Calciumionen verhindert BAPTA-Tetracesiumsalz deren Interaktion mit anderen Molekülen wie Proteinen und Enzymen. Dadurch wird die Aktivierung von calciumabhängigen zellulären Prozessen, einschließlich Muskelkontraktion und neuronaler Erregbarkeit, verhindert. Darüber hinaus behindert die Bindung von BAPTA-Tetracesiumsalz an Calciumionen die Aktivierung intrazellulärer Signalwege und erleichtert so die Untersuchung des Einflusses von Calcium auf zelluläre Mechanismen.
BAPTA-tetracesium Salt (CAS 480436-84-8) Literaturhinweise
- Regulierung von I(Cl,swell) in Neuroblastomzellen durch G-Protein-Signalwege. | Estevez, AY., et al. 2001. Am J Physiol Cell Physiol. 281: C89-98. PMID: 11401830
- Wirkung des extrazellulären pH-Wertes auf rekombinante alpha1beta2gamma2 und alpha1beta2 GABAA-Rezeptoren. | Mercik, K., et al. 2006. Neuropharmacology. 51: 305-14. PMID: 16725161
- Die Expression einer Sorcin-Missense-Mutation im Herzen moduliert die Erregungs-Kontraktions-Kopplung. | Collis, LP., et al. 2007. FASEB J. 21: 475-87. PMID: 17130302
- Benzodiazepin-Rezeptor-Agonisten beeinflussen sowohl die Bindung als auch das Gating von rekombinanten alpha1beta2gamma2 Gamma-Aminobuttersäure-A-Rezeptoren. | Mercik, K., et al. 2007. Neuroreport. 18: 781-5. PMID: 17471066
- Ranolazin verbessert die diastolische Dysfunktion in isoliertem Myokard aus versagenden menschlichen Herzen - Rolle des späten Natriumstroms und der intrazellulären Ionenakkumulation. | Sossalla, S., et al. 2008. J Mol Cell Cardiol. 45: 32-43. PMID: 18439620
- Endocannabinoide unterdrücken die exzitatorische synaptische Übertragung auf Serotonin-Neuronen in der dorsalen Raphe durch die Aktivierung von präsynaptischen CB1-Rezeptoren. | Haj-Dahmane, S. and Shen, RY. 2009. J Pharmacol Exp Ther. 331: 186-96. PMID: 19592666
- Diastolische Dysfunktion und Arrhythmien, die durch Überexpression von CaMKIIδ(C) verursacht werden, können durch Hemmung des späten Na(+)-Stroms rückgängig gemacht werden. | Sossalla, S., et al. 2011. Basic Res Cardiol. 106: 263-72. PMID: 21174213
- Die hemmende Wirkung von Önanthotoxin-Analoga auf GABA-erge Ströme in kultivierten Hippocampus-Neuronen der Ratte hängt von der Polarität der Polyacetylene ab. | Wyrembek, P., et al. 2012. Eur J Pharmacol. 683: 35-42. PMID: 22445880
- Ethanol hemmt dorsolaterale Striatal Medium Spiny Neurons durch Aktivierung eines präsynaptischen Delta-Opioid-Rezeptors. | Patton, MH., et al. 2016. Neuropsychopharmacology. 41: 1831-40. PMID: 26758662
- PIP2 in β-Zellen des Pankreas reguliert spannungsabhängige Kalziumkanäle über einen spannungsunabhängigen Weg. | de la Cruz, L., et al. 2016. Am J Physiol Cell Physiol. 311: C630-C640. PMID: 27488666
- Frühkindlicher Stress bestimmt die Auswirkungen von Glukokortikoiden und Stress auf die Funktion des Hippocampus: Elektrophysiologische und verhaltensbiologische Beweise. | Pillai, AG., et al. 2018. Neuropharmacology. 133: 307-318. PMID: 29412144
- PDGFRβ-Zellen leiten über das Chemokin CCL2 Entzündungssignale aus dem Kreislaufsystem schnell an Neuronen weiter. | Duan, L., et al. 2018. Neuron. 100: 183-200.e8. PMID: 30269986
- Die Entleerung der intrazellulären Kalziumvorräte durch den Kalziumionophor A23187 induziert die Gene für glukose-regulierte Proteine in Hamsterfibroblasten. | Drummond, IA., et al. 1987. J Biol Chem. 262: 12801-5. PMID: 3114264
- Die Transient Receptor Potential-Kanäle TRPV1 und TRPA1 in Melanozyten synergieren die UV-abhängige und UV-unabhängige Melanogenese. | Jia, Q., et al. 2021. Br J Pharmacol. 178: 4646-4662. PMID: 34363226
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
BAPTA-tetracesium Salt, 1 g | sc-503285 | 1 g | $398.00 |
