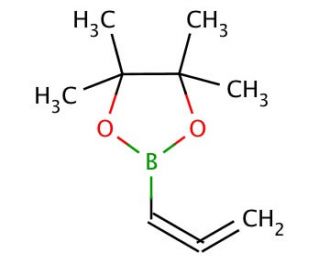
Allenylboronic acid pinacol ester (CAS 865350-17-0)
Direktverknüpfungen
Allenylboronsäure-Pinacolester ist eine vielseitige Verbindung, die in der organischen Synthese und der chemischen Forschung aufgrund ihrer Fähigkeit, an Kreuzkupplungsreaktionen teilzunehmen, häufig verwendet wird und als Vorläufer für die Synthese komplexer Molekülstrukturen dient. Diese Verbindung wird besonders für ihre Rolle bei Suzuki-Miyaura-Kupplungsreaktionen geschätzt, bei denen sie als Organobor-Reagenz Kohlenstoff-Kohlenstoff-Bindungen mit Aryl- oder Vinylhalogeniden unter Palladium-Katalyse bildet. Das Vorhandensein der Allenylgruppe im Molekül ermöglicht die Bildung hochkonjugierter Systeme durch nachfolgende Transformationen, die es den Forschern ermöglichen, architektonisch komplexe Moleküle mit Präzision zu konstruieren. Der Pinacolester-Anteil in seiner Struktur erhöht seine Stabilität und Löslichkeit, was seine Handhabung und Anwendung unter verschiedenen Reaktionsbedingungen erleichtert. Seine Verwendung in der chemischen Synthese ist von zentraler Bedeutung für die Entwicklung neuartiger Materialien, Katalysatoren und Synthesewege, was seine Bedeutung für den Fortschritt auf dem Gebiet der organischen Chemie widerspiegelt.
Allenylboronic acid pinacol ester (CAS 865350-17-0) Literaturhinweise
- Palladium-katalysierte Annulationsreaktionen für die diastereoselektive Cyclopentensynthese. | Kohn, BL. and Jarvo, ER. 2011. Org Lett. 13: 4858-61. PMID: 21854011
- Orts- und enantioselektive Bildung von Alkenyl-tragenden tertiären oder quaternären stereogenen Kohlenstoffzentren durch NHC-Cu-katalysierte allylische Substitution. | Jung, B. and Hoveyda, AH. 2012. J Am Chem Soc. 134: 1490-3. PMID: 22214185
- Verständnis des Mechanismus der asymmetrischen Propargylierung von Aldehyden mit Hilfe von 1,1'-Bi-2-Naphthol-Katalysatoren. | Grayson, MN. and Goodman, JM. 2013. J Am Chem Soc. 135: 6142-8. PMID: 23517191
- Silber-katalysierte enantioselektive Propargylierungsreaktionen von N-Sulfonylketiminen. | Osborne, CA., et al. 2015. Org Lett. 17: 5340-3. PMID: 26506430
- Sechzehn isostrukturelle metallorganische Phosphonatgerüste mit kontrollierter Lewis-Säure und chemischer Stabilität für die asymmetrische Katalyse. | Chen, X., et al. 2017. Nat Commun. 8: 2171. PMID: 29259195
- N-Heterozyklische Carben-Cu-katalysierte enantioselektive Allenyl-Konjugat-Addition. | Chong, Q., et al. 2018. Org Lett. 20: 6896-6900. PMID: 30350670
- Effiziente Methode zur Propargylierung von Aldehyden, gefördert durch Allenylboronverbindungen unter Mikrowellenbestrahlung. | Freitas, JJR., et al. 2020. Beilstein J Org Chem. 16: 168-174. PMID: 32117473
- Allenylboronsäure-Pinacol-Ester: Ein selektiver Partner für [4 + 2] Cycloadditionen. | Labadie, N., et al. 2021. Org Lett. 23: 5081-5085. PMID: 34151574
- Diels-Alder-Reaktivität von Allenylboronsäure-Pinacol-Ester und verwandten Dienophilen: Mechanistische Studien und Analyse des Distortion/Interaction-Activation Strain Model. | Labadie, N. and Pellegrinet, SC. 2022. J Org Chem. 87: 16776-16784. PMID: 36440689
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Allenylboronic acid pinacol ester, 1 g | sc-262980 | 1 g | $153.00 | |||
Allenylboronic acid pinacol ester, 5 g | sc-262980A | 5 g | $520.00 |
