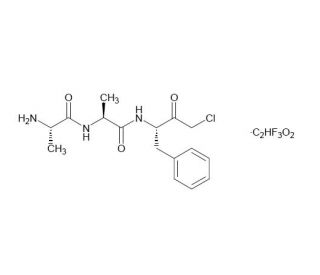
AAF-CMK (CAS 184901-82-4)
Produktreferenzen ansehen (1)
Direktverknüpfungen
AAF-CMK ist ein synthetisches Peptid, das als irreversibler Inhibitor dient und in der biochemischen Forschung zur Untersuchung der Proteaseaktivität, insbesondere von Serinproteasen, verwendet wird. Die Verbindung verfügt über eine Acetylgruppe und eine reaktive Chloromethylketon-Einheit, die mit der aktiven Stelle der Zielproteasen interagiert, was zur Alkylierung der Serinreste und somit zur Inaktivierung des Enzyms führt. Durch die Hemmung spezifischer Proteasen ermöglicht AAF-CMK Forschern, die Rolle dieser Enzyme in verschiedenen biologischen Prozessen wie Apoptose, Zellsignalgebung und dem Abbau intrazellulärer Proteine zu untersuchen. Es wird auch in der Erforschung der Protease-Regulation und der Spezifität von Enzym-Substrat-Interaktionen eingesetzt. Der Einsatz von AAF-CMK in biochemischen Assays hilft bei der Aufklärung der Mechanismen, die der Proteasefunktion zugrunde liegen, und deren Auswirkungen auf die zelluläre Physiologie und Pathologie. Darüber hinaus wird dieser Inhibitor bei der Entwicklung neuer Strategien zur Modulation der Proteaseaktivität eingesetzt, was Anwendungen in verschiedenen Bereichen wie der Biotechnologie und der Erforschung von Krankheitsbildern, in denen Proteasen eine Schlüsselrolle spielen, haben kann.
AAF-CMK (CAS 184901-82-4) Literaturhinweise
- Tripeptidylpeptidase I, das Genprodukt der spätinfantilen neuronalen Ceroidlipofuszinose, initiiert den lysosomalen Abbau der Untereinheit c der ATP-Synthase. | Ezaki, J., et al. 2000. J Biochem. 128: 509-16. PMID: 10965052
- Tripeptidylpeptidase II fördert die Reifung von Caspase-1 bei der durch Shigella flexneri ausgelösten Makrophagenapoptose. | Hilbi, H., et al. 2000. Infect Immun. 68: 5502-8. PMID: 10992446
- Auswirkungen eines Inhibitors der Tripeptidylpeptidase II (Ala-Ala-Phe-Chlormethylketon) und seiner Kombination mit einem Inhibitor der Chymotrypsin-ähnlichen Aktivität des Proteasoms (PSI) auf Apoptose, Zellzyklus und Proteasom-Aktivität in U937-Zellen. | Bury, M., et al. 2001. Folia Histochem Cytobiol. 39: 131-2. PMID: 11374791
- Verbindung zwischen organspezifischer Antigenverarbeitung durch 20S-Proteasomen und CD8(+)-T-Zellen-vermittelter Autoimmunität. | Kuckelkorn, U., et al. 2002. J Exp Med. 195: 983-90. PMID: 11956289
- Die strukturelle und enzymatische Charakterisierung von Physarolisin (früher Physaropepsin) beweist, dass es sich um eine einzigartige Serin-Carboxyl-Proteinase handelt. | Nishii, W., et al. 2003. Biochem Biophys Res Commun. 301: 1023-9. PMID: 12589815
- Das Gruppe-II-Chaperonin TRiC schützt proteolytische Zwischenprodukte vor dem Abbau im MHC-Klasse-I-Antigenverarbeitungsweg. | Kunisawa, J. and Shastri, N. 2003. Mol Cell. 12: 565-76. PMID: 14527404
- Gibt es eine Alternative zum Proteasom beim zytosolischen Proteinabbau? | Antón, LC. and Villasevil, EM. 2008. Biochem Soc Trans. 36: 839-42. PMID: 18793147
- Kalzium-unabhängige Phospholipase A2 beta ist für die Aktivierung des Inflammasoms und seine Hemmung durch Bromoenollacton entbehrlich. | Franchi, L., et al. 2009. J Innate Immun. 1: 607-17. PMID: 20160900
- Charakterisierung von Bortezomib-adaptierten I-45-Mesotheliomzellen. | Zhang, L., et al. 2010. Mol Cancer. 9: 110. PMID: 20482802
- Die Anhäufung von polyubiquitylierten Proteinen als Reaktion auf Ala-Ala-Phe-Chlormethylketon ist unabhängig von der Hemmung der Tripeptidylpeptidase II. | Villasevil, EM., et al. 2010. Biochim Biophys Acta. 1803: 1094-105. PMID: 20553980
- Der semispezifische TPPII-Inhibitor Ala-Ala-Phe-Chlormethylketon (AAF-cmk) zeigt zytotoxische Aktivität durch Induktion von Apoptose, Autophagie und Proteinaggregation in U937-Zellen. | Bialy, LP., et al. 2018. Folia Histochem Cytobiol. 56: 185-194. PMID: 30294774
- Ein High-Content-Screen identifiziert TPP1 und Aurora B als Regulatoren des axonalen mitochondrialen Transports. | Shlevkov, E., et al. 2019. Cell Rep. 28: 3224-3237.e5. PMID: 31533043
- Reinigung und Charakterisierung einer Tripeptidylaminopeptidase I aus der Rattenmilz. | Vines, D. and Warburton, MJ. 1998. Biochim Biophys Acta. 1384: 233-42. PMID: 9659384
- Eine Riesenprotease mit dem Potenzial, einige Funktionen des Proteasoms zu ersetzen. | Geier, E., et al. 1999. Science. 283: 978-81. PMID: 9974389
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
AAF-CMK, 5 mg | sc-205591 | 5 mg | $94.00 | |||
AAF-CMK, 25 mg | sc-205591A | 25 mg | $317.00 |
