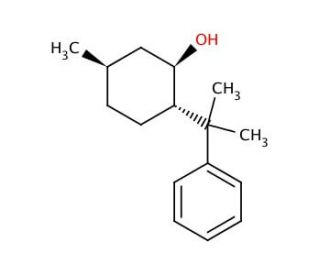
(−)-8-Phenylmenthol (CAS 65253-04-5)
Direktverknüpfungen
(-)-8-Phenylmenthol, ein chiraler Stoff mit breiter Anwendung in der organischen Synthese, der medizinischen Chemie und der Materialwissenschaft, hat eine große Bedeutung für wissenschaftliche Untersuchungen. Dieser Stoff, der aus Menthol abgeleitet ist, besitzt charakteristische Eigenschaften, die ihn für Forschungsbemühungen sehr wertvoll machen. Es wird postuliert, dass (-)-8-Phenylmenthol als Modulator verschiedener Ionenkanäle, einschließlich TRPM8 und TRPA1, dient, die bei verschiedenen physiologischen Prozessen wie Schmerzwahrnehmung, Thermoregulation und Entzündung eine entscheidende Rolle spielen. Darüber hinaus hat (-)-8-Phenylmenthol die Fähigkeit gezeigt, den GABA-A-Rezeptor zu aktivieren, ein entscheidender Bestandteil zur Regulierung von Angst und Sedierung.
(−)-8-Phenylmenthol (CAS 65253-04-5) Literaturhinweise
- Hochgradig diastereoselektive Synthese von Vinylcyclopropanderivaten mit (-)-8-Phenylmenthol als chiralem Hilfsstoff. | Ye, S., et al. 2001. J Org Chem. 66: 5717-22. PMID: 11511244
- Erste hochregio- und diastereoselektive [3+2]-Cycloaddition von chiralen nichtracemischen Fischer-Carben-Komplexen mit Azomethin-Yliden: eine enantioselektive Synthese von (+)-Rolipram. | Barluenga, J., et al. 2001. Chemistry. 7: 3533-44. PMID: 11560324
- Untersuchung der Auswirkungen der Struktur und Chelatgröße von Bis-Oxazolin-Liganden bei der asymmetrischen kupferkatalysierten Cyclopropanierung von Olefinen: Design einer neuen Klasse von Liganden. | Bedekar, AV., et al. 1997. J Org Chem. 62: 2518-2526. PMID: 11671592
- Neue Strategie für die stereoselektive Synthese von fluorierten beta-Aminosäuren. | Fustero, S., et al. 2002. J Org Chem. 67: 4667-79. PMID: 12098274
- Regio- und stereoselektive Herstellung von gamma-Butenoliden durch Phosphin-katalysierte Substitution von Morita-Baylis-Hillman-Acetaten: eine organokatalytische allylische Alkylierung. | Cho, CW. and Krische, MJ. 2004. Angew Chem Int Ed Engl. 43: 6689-91. PMID: 15593162
- Asymmetrische sigmatrope aza-[2,3]-Wittig-Umlagerungen: Kontrolle chiraler Hilfsstoffe und formal asymmetrische Synthese von (2S, 3R, 4R)-4-Hydroxy-3-methylprolin und (-)-Kainsäure. | Anderson, JC., et al. 2005. Org Biomol Chem. 3: 2741-9. PMID: 16032352
- Asymmetrische Synthese von fluorierten cyclischen beta-Aminosäurederivaten durch Kreuzmetathese. | Fustero, S., et al. 2006. Org Lett. 8: 4633-6. PMID: 16986968
- Asymmetrische Sommelet-Hauser-Umlagerung von N-Benzylammoniumsalzen. | Tayama, E. and Kimura, H. 2007. Angew Chem Int Ed Engl. 46: 8869-71. PMID: 17943952
- Kreuzmetathese-Reaktionen als effizientes Werkzeug bei der Synthese von fluorierten zyklischen beta-Aminosäuren. | Fustero, S., et al. 2009. J Org Chem. 74: 3414-23. PMID: 19348493
- Entwicklung einer neuen Familie von chiralen Hilfsstoffen. | Gelat, F., et al. 2015. Org Lett. 17: 1819-21. PMID: 25839090
- Synthese der privilegierten 8-Arylmenthol-Klasse durch radikalische Arylierung von Isopulegol. | Crossley, SW., et al. 2016. Org Lett. 18: 2620-3. PMID: 27175746
- Polymer-gestütztes (-)-8-Phenylmenthyl-Hilfsmittel als wirksamer Festphasen-Chiralinduktor bei der Addition von Nukleophilen an N-Acylimium-Ionen. | Forero-Doria, O., et al. 2017. Comb Chem High Throughput Screen. 20: 696-702. PMID: 28571539
- Enantiomerisch angereicherte α-Methylaminosäuren. Verwendung eines azyklischen, chiralen, von Alanin abgeleiteten Dianions mit hoher diastereofazialer Neigung. | Berkowitz, DB. and Smith, MK. 1995. J Org Chem. 60: 1233-1238. PMID: 29962540
- Ein umpolungsaktivierter, kupferkatalysierter, regioselektiver Hydroaminierungsansatz für α-Aminosäuren. | Nishino, S., et al. 2021. Chem Sci. 12: 11525-11537. PMID: 34567503
- Stereokontrollierter Zugang zu quartären Zentren durch Birch-Reduktion/Alkylierung chiraler Ester von Salicylsäuren. | Kozlowski, RA., et al. 2023. J Org Chem. 88: 6232-6236. PMID: 37040358
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
(−)-8-Phenylmenthol, 150 mg | sc-239130A | 150 mg | $80.00 | |||
(−)-8-Phenylmenthol, 250 mg | sc-239130 | 250 mg | $320.00 |
