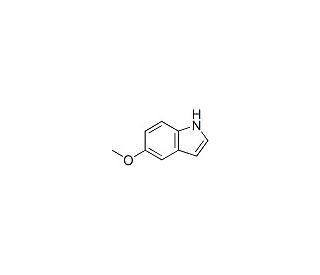
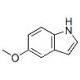
Molekülstruktur von 5-Methoxyindole, CAS-Nummer: 1006-94-6
5-Methoxyindole (CAS 1006-94-6)
Alternative Namen:
Femedol
Anwendungen:
5-Methoxyindole ist eine einfache Methoxyindolverbindung
CAS Nummer:
1006-94-6
Molekulargewicht:
147.17
Summenformel:
C9H9NO
Ausschließlich für Forschungszwecke. Nicht Geeignet für Verwendung in Diagnostik oder Therapie.
* Schauen Sie auf das Analysezertifikat (CoA), um die genauen Daten (inkl. Wassergehalt) Ihrer Produktionscharge (Lot) zu sehen.
Direktverknüpfungen
Bestellinformation
Beschreibung
Hintergrundinformationen
Sicherheitshinweis
SDS (SDB) & Analysenzertifikate
5-Methoxyindol ist eine einfache Methoxyindolverbindung. 5-Methoxyindol weist die reduzierte Struktur relevanter Indole der Tryptaminfamilie auf und ist eine nützliche Verbindung für die Synthese und Charakterisierung der Wechselwirkungen von Indolarten. 5-Methoxyindol zeigt einen partiellen Agonismus am 5-HT3A-Rezeptor und eine duale Aktivität als Agonist/umgekehrter Agonist am 5-HT3B-Rezeptor.
5-Methoxyindole (CAS 1006-94-6) Literaturhinweise
- Ein einfaches Verfahren zur Synthese von Roxindol, einem Dopamin-D2-Rezeptor-Agonisten. | Csende, F. 2001. Arch Pharm (Weinheim). 334: 253-4. PMID: 11512277
- Die 5-HT3B-Untereinheit sorgt für eine spontane Kanalöffnung und veränderte Ligandeneigenschaften des 5-HT3-Rezeptors. | Hu, XQ. and Peoples, RW. 2008. J Biol Chem. 283: 6826-31. PMID: 18187416
- Rotationsaufgelöste elektronische Spektroskopie von 5-Methoxyindol. | Brand, C., et al. 2010. J Chem Phys. 133: 024303. PMID: 20632751
- Mechanismus für die direkte Synthese von Tryptophan aus Indol und Serin: eine nützliche NMR-Technik zum Nachweis eines reaktiven Zwischenprodukts im Reaktionsgemisch. | Yokoyama, Y., et al. 2010. Magn Reson Chem. 48: 811-7. PMID: 20799376
- Konvergente Totalsynthesen der Amaryllidaceae-Alkaloide Lycoranin A, Lycoranin B und 2-Methoxypratosin. | Kim, HS., et al. 2013. J Org Chem. 78: 5103-9. PMID: 23607814
- Selbsthemmung eines ligandengesteuerten Ionenkanals: eine Überschneidung zwischen orthosterischen und allosterischen Stellen. | Hu, XQ. 2015. Br J Pharmacol. 172: 93-105. PMID: 25176133
- Biotransformation von Indol und seinen Derivaten durch einen neu isolierten Enterobacter sp. M9Z. | Qu, Y., et al. 2015. Appl Biochem Biotechnol. 175: 3468-78. PMID: 25725798
- Bestimmung der Dipolmomente im Grundzustand und im angeregten Zustand durch elektronische Stark-Spektroskopie: 5-Methoxyindol. | Wilke, J., et al. 2016. J Chem Phys. 144: 044201. PMID: 26827210
- Konformationsänderungen in 5-Methoxyindol: Auswirkungen von thermischen, schwingenden und elektronischen Anregungen. | Lopes Jesus, AJ., et al. 2017. J Phys Chem A. 121: 3372-3382. PMID: 28409925
- UV-induzierte Radikalbildung und Isomerisierung von 4-Methoxyindol und 5-Methoxyindol. | Lopes Jesus, AJ., et al. 2020. Phys Chem Chem Phys. 22: 22943-22955. PMID: 33026378
- Melatonin und seine Homologe induzieren Immunreaktionen über die Rezeptoren trP47363-trP13076 in Nicotiana benthamiana. | Kong, M., et al. 2021. Front Plant Sci. 12: 691835. PMID: 34276740
- Krötenalkaloid für die Entdeckung von Pestiziden: Dehydrobufotenin-Derivate als neuartige Wirkstoffe gegen Pflanzenviren und Pilze. | Tian, Z., et al. 2021. J Agric Food Chem. 69: 9754-9763. PMID: 34415761
- 5-Methoxyindol, ein chemisches Homolog von Melatonin, wirkt sich nachteilig auf den phytopathogenen Pilz Fusarium graminearum aus. | Kong, M., et al. 2021. Int J Mol Sci. 22: PMID: 34681652
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
5-Methoxyindole, 1 g | sc-202023 | 1 g | $36.00 | |||
5-Methoxyindole, 5 g | sc-202023A | 5 g | $118.00 |
