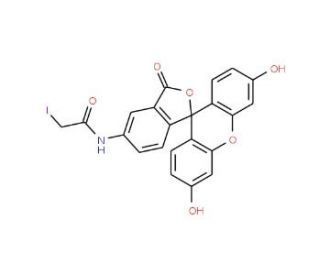
5-(Iodoacetamido)fluorescein (CAS 63368-54-7)
Direktverknüpfungen
5-(Iodacetamido)fluorescein ist ein Molekül, das in der biochemischen Forschung zur Markierung von Proteinen, Peptiden und anderen Biomolekülen verwendet wird. Seine Fähigkeit, sich über seine funktionelle Iodacetamidgruppe kovalent an Thiolgruppen in Cysteinresten zu binden, ist der Grund für seine häufige Anwendung in der Fluoreszenzmikroskopie und Durchflusszytometrie. Diese Verbindung ist besonders wertvoll für die Untersuchung von Proteinstruktur und -dynamik, da die gebundene Fluoresceineinheit ein Fluoreszenzsignal liefert, das nachgewiesen und quantifiziert werden kann. Bei der Untersuchung von Protein-Protein-Wechselwirkungen erleichtert 5-(Iodacetamido)fluorescein die Visualisierung komplexer Formationen und hilft so bei der Aufklärung molekularer Mechanismen. Es wird auch bei der Untersuchung von enzymatischen Aktivitäten und Konformationsänderungen in Proteinen eingesetzt, da sich die fluoreszierenden Eigenschaften der Verbindung bei der Bindung ändern und so ein Maß für die biochemischen Prozesse in Echtzeit liefern.
5-(Iodoacetamido)fluorescein (CAS 63368-54-7) Literaturhinweise
- Modulation des Redoxzustands von Tubulin durch das Glutathion/Glutaredoxin-Reduktase-System. | Landino, LM., et al. 2004. Biochem Biophys Res Commun. 314: 555-60. PMID: 14733943
- Redox-Modulation von Tau und Mikrotubuli-assoziiertem Protein-2 durch das Glutathion/Glutaredoxin-Reduktase-System. | Landino, LM., et al. 2004. Biochem Biophys Res Commun. 323: 112-7. PMID: 15351709
- Licht-induzierter Protonenschlupf und Protonenleck an der Thylakoidmembran. | Richter, M., et al. 2004. J Plant Physiol. 161: 1325-37. PMID: 15658803
- Empfindliche und selektive Bestimmung von Glutathion in probiotischen Bakterien mittels Kapillarelektrophorese und laserinduzierter Fluoreszenz. | Musenga, A., et al. 2007. Anal Bioanal Chem. 387: 917-24. PMID: 17203251
- Thiol-Modifikation von Proteinen durch Peroxynitrit-Anionen und Stickoxid-Donatoren. | Landino, LM. 2008. Methods Enzymol. 440: 95-109. PMID: 18423212
- Fluorescein als vielseitige Markierung für eine verbesserte Selektivität bei der Analyse von cysteinhaltigen Proteinen/Peptiden mittels Massenspektrometrie. | Chen, SH., et al. 2008. Anal Chem. 80: 5251-9. PMID: 18512949
- Hemmung der Tubulinpolymerisation durch hypochlorige Säure und Chloramine. | Landino, LM., et al. 2011. Free Radic Biol Med. 50: 1000-8. PMID: 21256958
- Kinetischer Mechanismus der Ca²⁺-gesteuerten Veränderungen des skelettalen Troponins I in Psoas-Myofibrillen. | Lopez-Davila, AJ., et al. 2012. Biophys J. 103: 1254-64. PMID: 22995498
- Die Oxidation von Tubulin-Cysteinen durch Hypothiocyansäure hemmt die Mikrotubuli-Polymerisation. | Clark, HM., et al. 2014. Arch Biochem Biophys. 541: 67-73. PMID: 24215946
- Redox-Proteomics-Veränderungen im Pilzerreger Trichosporon asahii bei Arsenexposition: Identifizierung von Proteinreaktionen auf metallinduzierten oxidativen Stress in einem Isolat aus einer Umweltprobe. | Ilyas, S., et al. 2014. PLoS One. 9: e102340. PMID: 25062082
- Nachweis von Thiol/Disulfid-Austauschreaktionen zwischen Tubulin und Glyceraldehyd-3-phosphat-Dehydrogenase. | Landino, LM., et al. 2014. Cytoskeleton (Hoboken). 71: 707-18. PMID: 25545749
- Protein-Protein-Wechselwirkungen bei der Kontaktaktivierung der Blutgerinnung. Bindung von hochmolekularem Kininogen und der 5-(Jodacetamido)-Fluorescein-markierten leichten Kininogenkette an Präkallikrein, Kallikrein und die getrennten schweren und leichten Kallikrein-Ketten. | Bock, PE., et al. 1985. J Biol Chem. 260: 12434-43. PMID: 3850090
- Konformation von Xanthen-Farbstoffen in der Sulfhydryl-1-Bindungsstelle von Myosin. 2. | Ajtai, K. and Burghardt, TP. 1995. Biochemistry. 34: 15943-52. PMID: 8519751
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
5-(Iodoacetamido)fluorescein, 25 mg | sc-214304 | 25 mg | $162.00 | |||
5-(Iodoacetamido)fluorescein, 100 mg | sc-214304A | 100 mg | $537.00 | |||
5-(Iodoacetamido)fluorescein, 250 mg | sc-214304B | 250 mg | $1200.00 |
