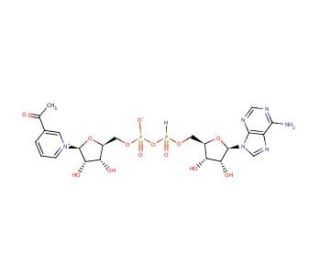
Molekülstruktur von 3-Acetylpyridine adenine dinucleotide, CAS-Nummer: 86-08-8
3-Acetylpyridine adenine dinucleotide (CAS 86-08-8)
Produktreferenzen ansehen (3)
Alternative Namen:
APAD, Oxidized
Anwendungen:
3-Acetylpyridine adenine dinucleotide ist ein Analogon von NAD
CAS Nummer:
86-08-8
Reinheit:
≥92%
Molekulargewicht:
662.44
Summenformel:
C22H28N6O14P2
Ausschließlich für Forschungszwecke. Nicht Geeignet für Verwendung in Diagnostik oder Therapie.
* Schauen Sie auf das Analysezertifikat (CoA), um die genauen Daten (inkl. Wassergehalt) Ihrer Produktionscharge (Lot) zu sehen.
Direktverknüpfungen
Bestellinformation
Publikationen
Beschreibung
Hintergrundinformationen
Sicherheitshinweis
SDS (SDB) & Analysenzertifikate
3-Acetylpyridinadenindinukleotid ist ein NAD-Analogon mit einem höheren Oxidationspotential als NAD. Es kann als Hydrogen-akzeptierender Cofaktor in vielen Dehydrogenase-Reaktionen anstelle von NAD dienen, z.B. Lactat-Dehydrogenase aus Toxoplasma, Clonorchis und Plasmodium, bakterielle Lipoamid-Dehydrogenase sowie menschliche Dehydrogenasen. Diese Verbindung kann auch als Protonenakzeptor in verschiedenen Transhydrogenationsreaktionen mit NADH oder NADPH dienen.
3-Acetylpyridine adenine dinucleotide (CAS 86-08-8) Literaturhinweise
- Die kinetischen Eigenschaften und die Empfindlichkeit gegenüber Inhibitoren von Laktatdehydrogenasen (LDH1 und LDH2) aus Toxoplasma gondii: Vergleiche mit pLDH aus Plasmodium falciparum. | Dando, C., et al. 2001. Mol Biochem Parasitol. 118: 23-32. PMID: 11704270
- Kinetik der Transhydrogenase-Reaktion, die von der mitochondrialen NADH:Ubichinon-Oxidoreduktase (Komplex I) katalysiert wird. | Zakharova, NV. 2002. Biochemistry (Mosc). 67: 651-61. PMID: 12126472
- Struktur der LDH1 von Toxoplasma gondii: Unterschiede zwischen der aktiven Stelle und menschlichen Laktatdehydrogenasen und die strukturelle Grundlage für eine effiziente APAD+-Nutzung. | Kavanagh, KL., et al. 2004. Biochemistry. 43: 879-89. PMID: 14744130
- Molekulare Klonierung und Charakterisierung eines neuen Laktatdehydrogenase-Gens aus Clonorchis sinensis. | Yang, G., et al. 2006. Parasitol Res. 99: 55-64. PMID: 16479375
- Künstliche Elektronenträger für die photoenzymatische Synthese unter sichtbarem Licht. | Lee, SH., et al. 2012. Chemistry. 18: 5490-5. PMID: 22488767
- Eine enzymatische Zyklusmethode für 3-Acetylpyridin-Adenin-Dinukleotid zur Erhöhung der Empfindlichkeit von enzymatischen Methoden, die dieses NAD-Analogon verwenden. | Ferrier, B. 1990. Anal Biochem. 186: 229-32. PMID: 2363493
- Thioredoxin-Reduktase-Typ Ferredoxin: NADP+ Oxidoreduktase von Rhodopseudomonas palustris: Potentiometrische Eigenschaften und Reaktionen mit nichtphysiologischen Oxidationsmitteln. | Lesanavičius, M., et al. 2022. Antioxidants (Basel). 11: PMID: 35624864
- Die Analyse des kinetischen Mechanismus der Enterokokken-NADH-Peroxidase zeigt die katalytische Rolle von NADH-Komplexen sowohl mit oxidierten als auch mit zwei Elektronen reduzierten Enzymformen. | Crane, EJ., et al. 1995. Biochemistry. 34: 14114-24. PMID: 7578008
- Der Mechanismus des Hydridtransfers zwischen NADH und 3-Acetylpyridin-Adenin-Dinucleotid durch die Pyridin-Nucleotid-Transhydrogenase von Escherichia coli. | Glavas, NA. and Bragg, PD. 1995. Biochim Biophys Acta. 1231: 297-303. PMID: 7578217
- Hohe zyklische Transhydrogenase-Aktivität, katalysiert durch exprimierte und rekonstituierte Nukleotid-bindende Domänen der Rhodospirillum rubrum Transhydrogenase. | Yamaguchi, M. and Hatefi, Y. 1997. Biochim Biophys Acta. 1318: 225-34. PMID: 9030266
- Proteintechnische Tests eines Homologiemodells der Laktatdehydrogenase von Plasmodium falciparum. | Hewitt, CO., et al. 1997. Protein Eng. 10: 39-44. PMID: 9051732
- Katalytische Eigenschaften der Lipoamid-Dehydrogenase aus Mycobacterium smegmatis. | Marcinkeviciene, J. and Blanchard, JS. 1997. Arch Biochem Biophys. 340: 168-76. PMID: 9143318
- Die Reduktion von Acetylpyridin-Adenin-Dinukleotid durch NADH: ist sie eine bedeutende Reaktion der protonenverlagernden Transhydrogenase oder ein Artefakt? | Stilwell, SN., et al. 1997. Biochim Biophys Acta. 1320: 83-94. PMID: 9186780
- Mutationen an Tyrosin-235 in der mobilen Schleifenregion des Domäne-I-Proteins der Transhydrogenase aus Rhodospirillum rubrum hemmen den Hydridtransfer stark. | Bizouarn, T., et al. 1997. Biochim Biophys Acta. 1320: 265-74. PMID: 9230921
- Substrat- und Kofaktorspezifität und selektive Hemmung der Laktatdehydrogenase aus dem Malariaparasiten P. falciparum. | Gomez, MS., et al. 1997. Mol Biochem Parasitol. 90: 235-46. PMID: 9497046
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
3-Acetylpyridine adenine dinucleotide, 25 mg | sc-209519 | 25 mg | $105.00 | |||
3-Acetylpyridine adenine dinucleotide, 100 mg | sc-209519A | 100 mg | $304.00 |
