Subscrever / Inscrever-se Conta
Corrinho de compra (0)
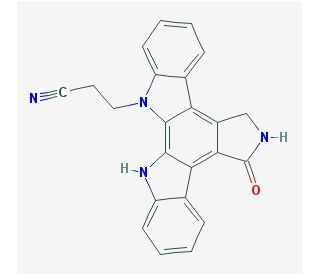
Estrutura molecular do NGIC-I
NGIC-I
Aplicacao:
NGIC-I é um inibidor potente, permeável às células e seletivo da PKC
Privada:
≥95%
Peso Molecular:
364.4
Separar por Funcao:
C23H16N4O
Para uso em exclusivo em pesquisa. Não se destina a uso em diagnostico e tratamento.
* Refere-se a Certificado de Análise para data especifica de lotes (incluindo-se o conteúdo de agua).
LINKS RÁPIDOS
Informacoes sobre ordens
Descricao
Informações Técnicas
Informações de Segurança
SDS & Certificado de Análise
O NGIC-I é um indolocarbazol seletivo e permeável às células, que funciona como um inibidor da PKC (proteína quinase C). Estudos sobre o CMV (citomegalovírus) humano mostram que as UL97 cinases podem ser inibidas pelo NGIC-I. Em resultado da inibição das UL 97 cinases por NGIC-I, forma-se um agregado de tegumento citoplasmático aberrante rico em pp65. Estudos indicam que a proteína quinase C está envolvida em muitas cascatas de sinalização através da sua função de fosforilar proteínas. A capacidade de regular esta proteína é muito útil para controlar as cascatas de transdução de sinal. O NGIC-I é um inibidor da cGKI.
NGIC-I Referencias
- Os inibidores da replicação do citomegalovírus humano reduzem drasticamente a atividade da proteína quinase viral pUL97. | Marschall, M., et al. 2001. J Gen Virol. 82: 1439-1450. PMID: 11369889
- A seleção direta da proteína cinase pUL97 do citomegalovírus humano por inibidores da cinase é um novo princípio para a terapia antiviral. | Marschall, M., et al. 2002. J Gen Virol. 83: 1013-1023. PMID: 11961255
- A proteína cinase pUL97 do citomegalovírus humano interage com o fator de processividade da DNA polimerase pUL44 e fosforila-o. | Marschall, M., et al. 2003. Virology. 311: 60-71. PMID: 12832203
- Mecanismo de fosforilação da caveolina-1 dependente do fator de crescimento derivado das plaquetas: relação com a ligação aos esteróis e o papel da serina-80. | Fielding, PE., et al. 2004. Biochemistry. 43: 2578-86. PMID: 14992595
- A proteína cinase UL97 do citomegalovírus humano e homólogos noutros herpesvírus: impacto no vírus e no hospedeiro. | Michel, D. and Mertens, T. 2004. Biochim Biophys Acta. 1697: 169-80. PMID: 15023359
- Efeitos do maribavir e de indolocarbazóis seleccionados na proteína quinase BGLF4 do vírus Epstein-Barr e na replicação lítica viral. | Gershburg, E., et al. 2004. Antimicrob Agents Chemother. 48: 1900-3. PMID: 15105156
- Nova classe química de inibidores específicos da proteína quinase pUL97 com forte atividade anticitomegalovírica. | Herget, T., et al. 2004. Antimicrob Agents Chemother. 48: 4154-62. PMID: 15504835
- Identificação de inibidores de uma proteína cinase codificada por vírus através de 2 sistemas de rastreio diferentes: ensaio de cinase in vitro e ensaio de atividade em células. | Mett, H., et al. 2005. J Biomol Screen. 10: 36-45. PMID: 15695342
- Alterações estruturais nos locais de montagem citoplasmática do citomegalovírus humano na ausência de atividade da quinase UL97. | Azzeh, M., et al. 2006. Virology. 354: 69-79. PMID: 16872656
- A análise da relação estrutura-atividade de quatro proteínas quinases da subfamília UL97 do herpesvírus revela uma conservação funcional parcial mas não total. | Romaker, D., et al. 2006. J Med Chem. 49: 7044-53. PMID: 17125257
- Fosforilação da proteína do retinoblastoma por uma proteína viral com função de quinase dependente de ciclina. | Hume, AJ., et al. 2008. Science. 320: 797-9. PMID: 18467589
- As funções cinase e não cinase do citomegalovírus humano UL97 medeiam o envolvimento secundário citoplasmático viral. | Goldberg, MD., et al. 2011. J Virol. 85: 3375-84. PMID: 21248036
- O citomegalovírus humano pUL97 regula positivamente a expressão de SOCS3 através do fator de transcrição RFX7 em células progenitoras neurais. | Wang, XZ., et al. 2023. PLoS Pathog. 19: e1011166. PMID: 36753521
Inibidor de:
cGKI, PKC, e Ser/Thr Protein Kinase.Informacoes sobre ordens
| Nome do Produto | Numero de Catalogo | UNID | Preco | Qde | FAVORITOS | |
NGIC-I, 500 µg | sc-222073 | 500 µg | $306.00 |
