Subscrever / Inscrever-se Conta
Corrinho de compra (0)
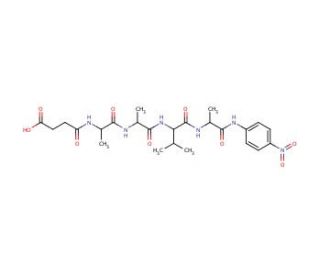
Estrutura molecular do N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide, Número CAS: 108322-03-8
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide (CAS 108322-03-8)
Aplicacao:
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide é um substrato enzimático
Numero VAT:
108322-03-8
Peso Molecular:
550.56
Separar por Funcao:
C24H34N6O9
Para uso em exclusivo em pesquisa. Não se destina a uso em diagnostico e tratamento.
* Refere-se a Certificado de Análise para data especifica de lotes (incluindo-se o conteúdo de agua).
LINKS RÁPIDOS
Informacoes sobre ordens
Descricao
Informações Técnicas
Informações de Segurança
SDS & Certificado de Análise
A p-nitroanilida N-Succinil-Ala-Ala-Val-Ala desempenha um papel crucial em diversos campos de pesquisa científica. Suas aplicações abrangem o estudo de interações proteína-proteína, síntese de proteínas, inibição de enzimas e ensaios bioquímicos. Esse substrato peptídico, N-Succinil-Ala-Ala-Val-Ala p-nitroanilida, facilita o exame da atividade enzimática. Ao se ligar ao local ativado da enzima, ele aciona a conversão catalítica do substrato em um produto. Posteriormente, o produto é liberado, permitindo que a enzima volte ao seu estado inicial.
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide (CAS 108322-03-8) Referencias
- Purificação e caraterização de uma serina protease intracelular do tipo quimotripsina de Thermoplasma volcanium. | Kocabiyik, S. and Ozdemir, I. 2006. Biosci Biotechnol Biochem. 70: 126-34. PMID: 16428830
- Especificidade do substrato e termoestabilidade da protease alcalina de dehairing de Bacillus pumilus. | Wan, MY., et al. 2009. Appl Biochem Biotechnol. 159: 394-403. PMID: 19132554
- Um novo alcaloide de isoquinolina, inibidor da DD-carboxipeptidase, com atividade antibacteriana isolado de Streptomyces sp. 8812. Parte I: Taxonomia, fermentação, isolamento e actividades biológicas. | Solecka, J., et al. 2009. J Antibiot (Tokyo). 62: 575-80. PMID: 19713994
- As substituições de Gly ou Ala por Pro(210)Thr(211)Asn(212) na curva β8-β9 da subtilisina Carlsberg aumentam a taxa catalítica e diminuem a termoestabilidade. | Fuchita, N., et al. 2012. Biochim Biophys Acta. 1824: 620-6. PMID: 22326746
- Perspectivas estruturais e mecanicistas sobre a degradação do colagénio por uma serina protease colagenolítica bacteriana da família das subtilisinas. | Ran, LY., et al. 2013. Mol Microbiol. 90: 997-1010. PMID: 24112706
- A tetramerização induzida pelo cálcio e a quelação de zinco protegem a calprotectina humana da degradação por proteases extracelulares bacterianas e do hospedeiro. | Stephan, JR. and Nolan, EM. 2016. Chem Sci. 7: 1962-1975. PMID: 26925211
- Caracterização de uma nova serina protease S8 de Photobacterium sp. A5-7 de sedimentos marinhos e a função do seu domínio associado à protease. | Li, HJ., et al. 2016. Front Microbiol. 7: 2016. PMID: 28066343
- Estrutura cristalina de uma protease ativa a frio (Pro21717) da bactéria psicrófila, Pseudoalteromonas arctica PAMC 21717, com uma resolução de 1,4 Å: Adaptações estruturais ao frio e análise funcional de uma enzima de detergente para a roupa. | Park, HJ., et al. 2018. PLoS One. 13: e0191740. PMID: 29466378
- Protease alcalina microbiana marinha: Uma ferramenta eficiente e essencial para várias aplicações industriais. | Barzkar, N. 2020. Int J Biol Macromol. 161: 1216-1229. PMID: 32534091
Substrato de:
Enzyme.Informacoes sobre ordens
| Nome do Produto | Numero de Catalogo | UNID | Preco | Qde | FAVORITOS | |
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide, 25 mg | sc-215479 | 25 mg | $151.00 |
