Subscrever / Inscrever-se Conta
Corrinho de compra (0)
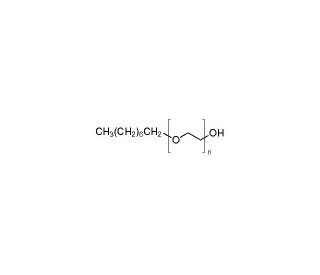
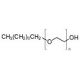
Estrutura molecular do n-Octyl-oligo-oxyethylene, Número CAS: 27252-75-1
n-Octyl-oligo-oxyethylene (CAS 27252-75-1)
Nomes alternativos:
Octyl-POE
Aplicacao:
n-Octyl-oligo-oxyethylene é um detergente útil para a solubilização, purificação e cristalização de proteínas
Numero VAT:
27252-75-1
Separar por Funcao:
C8H18O(C2H4O)n
Para uso em exclusivo em pesquisa. Não se destina a uso em diagnostico e tratamento.
* Refere-se a Certificado de Análise para data especifica de lotes (incluindo-se o conteúdo de agua).
LINKS RÁPIDOS
Informacoes sobre ordens
Descricao
Informações Técnicas
Informações de Segurança
SDS & Certificado de Análise
O n-Octyl-oligo-oxyethylene (2-OE) é um detergente para solubilização, purificação e cristalização de proteínas de membrana. O n-Octil-oligo-oxietileno é usado como solvente, surfactante e emulsificante em muitos produtos industriais e de consumo, como produtos de limpeza, cosméticos e produtos de higiene pessoal. Também é usado como reagente ou catalisador em síntese orgânica e na produção de produtos farmacêuticos e corantes. Além disso, foi demonstrado que podem ser usados para diminuir a viscosidade do muco, ter efeitos anti-inflamatórios e ter um efeito protetor na pele.
n-Octyl-oligo-oxyethylene (CAS 27252-75-1) Referencias
- Regiões de lipopolissacarídeos envolvidas na ativação da protease de membrana externa OmpT de Escherichia coli. | Kramer, RA., et al. 2002. Eur J Biochem. 269: 1746-52. PMID: 11895445
- As estruturas cristalinas explicam as propriedades funcionais de duas porinas de E. coli. | Cowan, SW., et al. 1992. Nature. 358: 727-33. PMID: 1380671
- O papel crítico dos detergentes na cristalização de proteínas de membrana. | Rosenbusch, JP. 1990. J Struct Biol. 104: 134-8. PMID: 2088442
- Cristalização e caraterização preliminar por raios X da maltoporina de Escherichia coli. | Stauffer, KA., et al. 1990. J Mol Biol. 211: 297-9. PMID: 2137884
- Marcação topográfica de proteínas formadoras de poros da membrana externa de Escherichia coli. | Page, MG. and Rosenbusch, JP. 1986. Biochem J. 235: 651-61. PMID: 2428354
- A estrutura beta densamente compactada na interface proteína-lípido da porina é revelada por microscopia crioelectrónica de alta resolução. | Sass, HJ., et al. 1989. J Mol Biol. 209: 171-5. PMID: 2553985
- Concentrações micelares críticas de detergentes. | Zulauf, M., et al. 1989. Methods Enzymol. 172: 528-38. PMID: 2747541
- Os tripletos de canais de porina fundem-se em saídas únicas nas membranas externas de Escherichia coli. | Engel, A., et al. Nature. 317: 643-5. PMID: 2997617
- Caracterização da principal proteína do envelope de Escherichia coli. Disposição regular no peptidoglicano e ligação invulgar ao dodecil sulfato. | Rosenbusch, JP. 1974. J Biol Chem. 249: 8019-29. PMID: 4609976
- Um novo procedimento para o isolamento da proteína básica da mielina do cérebro numa forma ligada a lípidos. | Riccio, P., et al. 1984. FEBS Lett. 177: 236-40. PMID: 6209168
- Topologia da proteína recetora do fago lambda. Mapeamento de alvos de clivagem proteolítica em relação a locais de ligação para fagos ou anticorpos monoclonais. | Schenkman, S., et al. 1984. J Biol Chem. 259: 7570-6. PMID: 6234303
- A citocromo c oxidase solubilizada de Paracoccus denitrificans é um monómero. | Ludwig, B., et al. 1982. J Biol Chem. 257: 5576-8. PMID: 6279605
- A unidade reguladora Ns do GTP estimulador e a unidade catalítica da adenilato ciclase estão estreitamente associadas: consequências mecanísticas. | Arad, H., et al. 1984. Proc Natl Acad Sci U S A. 81: 6579-83. PMID: 6436817
- Sistema de fosfotransferase bacteriana. Solubilização e purificação da enzima II específica da glucose a partir de membranas de Salmonella typhimurium. | Erni, B., et al. 1982. J Biol Chem. 257: 13726-30. PMID: 6754716
Informacoes sobre ordens
| Nome do Produto | Numero de Catalogo | UNID | Preco | Qde | FAVORITOS | |
n-Octyl-oligo-oxyethylene, 5 ml | sc-286437 | 5 ml | $260.00 | |||
n-Octyl-oligo-oxyethylene, 25 ml | sc-286437A | 25 ml | $364.00 |
