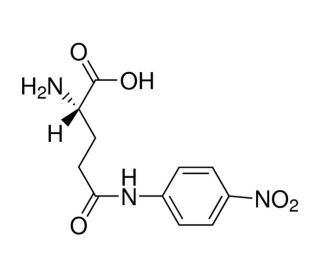
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6)
LINKS RÁPIDOS
O ácido L-glutâmico γ-(4-nitroanilida) é um composto que funciona como substrato para a enzima γ-glutamiltransferase (GGT) em vários ensaios bioquímicos. Quando utilizado em aplicações experimentais, o ácido L-glutâmico γ-(4-nitroanilida) funciona como um substrato específico para a GGT, permitindo a medição da atividade da GGT em amostras biológicas. Após interação com a GGT, o ácido L-glutâmico γ-(4-nitroanilida) sofre uma clivagem enzimática, resultando na libertação de 4-nitroanilina. Esta reação pode ser medida quantitativamente utilizando métodos espectrofotométricos, fornecendo informações sobre os níveis de atividade da GGT em sistemas biológicos. O mecanismo de ação do ácido L-glutâmico γ-(4-nitroanilida) envolve o seu reconhecimento específico e a sua clivagem pela enzima GGT, levando à geração de um produto mensurável.
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6) Referencias
- Relação não linear de energia livre na acilação catalisada por ácidos gerais da gama-glutamil transpeptidase de rim de rato por uma série de análogos do substrato gama-glutamil anilida. | Ménard, A., et al. 2001. Biochemistry. 40: 12678-85. PMID: 11601992
- A caraterização da gama-glutamiltranspeptidase de Helicobacter pylori revela a base molecular para a especificidade do substrato e um papel crítico para a ansa contendo tirosina 433 na catálise. | Morrow, AL., et al. 2007. Biochemistry. 46: 13407-14. PMID: 17960917
- A estrutura cristalina da gama-glutamiltranspeptidase inibida pela acivicina revela o papel crítico do seu terminal C no autoprocessamento e na catálise. | Williams, K., et al. 2009. Biochemistry. 48: 2459-67. PMID: 19256527
- Propriedades bioquímicas e estruturais da gama-glutamil transpeptidase de Geobacillus thermodenitrificans: uma enzima especializada na atividade de hidrolase. | Castellano, I., et al. 2010. Biochimie. 92: 464-74. PMID: 20138205
- Clonagem de genes e expressão de proteínas de γ-glutamiltranspeptidases de Thermus thermophilus e Deinococcus radiodurans: comparação de propriedades moleculares e estruturais com homólogos mesófilos. | Castellano, I., et al. 2011. Extremophiles. 15: 259-70. PMID: 21298394
- Caracterização de MtfA, uma nova proteína reguladora do sinal de saída do sistema glucose-fosfotransferase em Escherichia coli K-12. | Göhler, AK., et al. 2012. J Bacteriol. 194: 1024-35. PMID: 22178967
- γ-Glutamiltranspeptidases: sequência, estrutura, propriedades bioquímicas e aplicações biotecnológicas. | Castellano, I. and Merlino, A. 2012. Cell Mol Life Sci. 69: 3381-94. PMID: 22527720
- Especificidade do substrato doador da gama-glutamiltransferase do rim bovino. | Agblor, AA. and Josephy, PD. 2013. Chem Biol Interact. 203: 480-5. PMID: 23500672
- Purificação parcial e propriedades da gama-glutamiltranspeptidase de micélios de Morchella esculenta. | Moriguchi, M., et al. 1986. Arch Microbiol. 144: 15-9. PMID: 2870692
- Comportamento da L-gama-glutamil-4-nitroanilida e da L-gama-glutamil-3-carboxi-4-nitroanilida em relação a gama-glutamiltransferases de origem diferente. | Verhoeff, PM., et al. 1988. Clin Chim Acta. 175: 129-34. PMID: 2900705
- Caracterização da distribuição e função da lisozima de tipo i de Apostichopus japonicus. | Li, C., et al. 2018. Fish Shellfish Immunol. 74: 419-425. PMID: 29079205
- Um Bioink Derivado de ECM renal Fototranslinável acelera a formação de tecido Renal. | Ali, M., et al. 2019. Adv Healthc Mater. 8: e1800992. PMID: 30725520
- Biodistribuição do cobre após administração sistémica aguda de gluconato de cobre a ratos. | García-Martínez, BA., et al. 2021. Biometals. 34: 687-700. PMID: 33900531
- Tridegina, um novo inibidor peptídico do fator XIIIa, da sanguessuga Haementeria ghilianii. | Finney, S., et al. 1997. Biochem J. 324 (Pt 3): 797-805. PMID: 9210403
- Análise das propriedades cinéticas da gama-glutamil transpeptidase do rim de rato. | Dvoráková, L., et al. 1996. Gen Physiol Biophys. 15: 403-13. PMID: 9228521
Informacoes sobre ordens
| Nome do Produto | Numero de Catalogo | UNID | Preco | Qde | FAVORITOS | |
L-Glutamic acid γ-(4-nitroanilide), 1 g | sc-250219 | 1 g | $48.00 |
