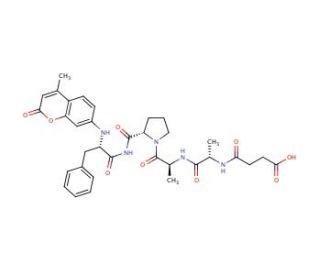
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2)
LINKS RÁPIDOS
O Substrato II de Quimotripsina, Fluorogénico é um peptídeo especialmente concebido para servir de substrato à enzima quimotripsina, uma protease digestiva que cliva as ligações peptídicas no lado carboxílico de aminoácidos aromáticos como a tirosina, o triptofano e a fenilalanina. O aspeto fluorogénico deste substrato significa que, após a clivagem enzimática pela quimotripsina, liberta um sinal fluorescente, permitindo a monitorização em tempo real da atividade da enzima. Esta propriedade torna-o uma ferramenta inestimável em várias aplicações analíticas e de investigação, particularmente no estudo da atividade das proteases e no rastreio de inibidores. Ao medir o aumento da intensidade da fluorescência à medida que o substrato é clivado, os investigadores podem determinar a velocidade da enzima, a afinidade do substrato (Km) e a eficiência catalítica (kcat), fornecendo informações sobre o seu mecanismo catalítico.
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2) Referencias
- Prova de que a ciclofilina-A protege as células contra o stress oxidativo. | Doyle, V., et al. 1999. Biochem J. 341 (Pt 1): 127-32. PMID: 10377253
- A ciclofilina-A está envolvida na ativação da caspase induzida por excitotoxinas nas células neuronais B50 do rato. | Capano, M., et al. 2002. Biochem J. 363: 29-36. PMID: 11903043
- Desenvolvimento de ensaios de proteases baseados em espetrometria de massa com plasma indutivamente acoplado. | Lathia, US., et al. 2010. Anal Biochem. 398: 93-8. PMID: 19912984
- Expressão funcional de um novo inibidor de protease do tipo Kunitz do verme do sangue humano Schistosoma mansoni. | Ranasinghe, SL., et al. 2015. Parasit Vectors. 8: 408. PMID: 26238343
- Clonagem e Caracterização de Dois Potentes Inibidores de Proteases do Tipo Kunitz de Echinococcus granulosus. | Ranasinghe, SL., et al. 2015. PLoS Negl Trop Dis. 9: e0004268. PMID: 26645974
- Atividade Sinérgica entre Duas Proteínas Antifúngicas, a Defensina Vegetal NaD1 e o Inibidor de Tripsina Pancreática Bovina. | Bleackley, MR., et al. 2017. mSphere. 2: PMID: 29062897
- Estruturas cristalinas do complexo de um inibidor de calicreína de Bauhinia bauhinioides com tripsina e modelação de complexos de calicreína. | Li, M., et al. 2019. Acta Crystallogr D Struct Biol. 75: 56-69. PMID: 30644845
- A absorção de quimase pelos cardiomiócitos resulta na degradação da miosina na sobrecarga de volume cardíaco. | Powell, PC., et al. 2019. Heliyon. 5: e01397. PMID: 30997426
- A Inibição da Catepsina G por Serpinb1 e Serpinb6 Previne a Necrose Programada em Neutrófilos e Monócitos e Reduz a Inflamação Provocada pela GSDMD. | Burgener, SS., et al. 2019. Cell Rep. 27: 3646-3656.e5. PMID: 31216481
- Seleção e identificação de inibidores da metacaspase: Avaliação do Mecanismo de Inibição e da Atividade Tripanocida. | Pérez, B., et al. 2021. Antimicrob Agents Chemother. 65: PMID: 33318019
- Inibidores reversíveis fotocomutáveis geram ultra-sensibilidade em reacções enzimáticas fora do equilíbrio. | Teders, M., et al. 2021. J Am Chem Soc. 143: 5709-5716. PMID: 33844531
- Clivagem proteolítica de péptidos bioactivos e de receptores activados por proteases na colite aguda e pós-colite. | De Bruyn, M., et al. 2021. Int J Mol Sci. 22: PMID: 34639054
- O Efeito dos Inibidores de Serina Protease na Dor Visceral em Diferentes Modelos de Roedores com Insulto Intestinal. | Ceuleers, H., et al. 2022. Front Pharmacol. 13: 765744. PMID: 35721192
- Actividades enzimáticas extracelulares de estirpes de fungos pelágicos oceânicos e a influência da temperatura. | Salazar Alekseyeva, K., et al. 2022. J Fungi (Basel). 8: PMID: 35736054
- Descoberta e base molecular de inibidores selectivos do subtipo de ciclofilina. | Peterson, AA., et al. 2022. Nat Chem Biol. 18: 1184-1195. PMID: 36163383
Informacoes sobre ordens
| Nome do Produto | Numero de Catalogo | UNID | Preco | Qde | FAVORITOS | |
Chymotrypsin Substrate II, Fluorogenic, 25 mg | sc-391097 | 25 mg | $193.00 |
