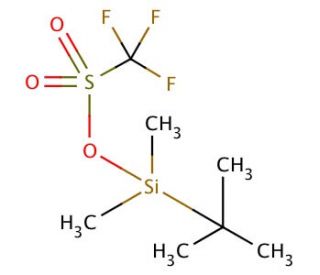
tert-Butyldimethylsilyl trifluoromethanesulfonate (CAS 69739-34-0)
LINKS RÁPIDOS
O trifluorometanosulfonato de terc-butildimetilsilila (TBDMS-Tf) é um composto de organossilício amplamente empregado como reagente eletrofílico para a introdução de grupos t-butildimetilsilila. É um líquido incolor, solúvel em vários solventes orgânicos, como éter, acetona e clorofórmio. Além disso, o trifluorometanosulfonato de terc-butildimetilsilil apresenta solubilidade em água, possuindo um ponto de ebulição mais alto em comparação com a maioria dos solventes orgânicos. Com suas diversas aplicações em síntese orgânica, o trifluorometanosulfonato de terc-butildimetilsilil encontra amplo uso na criação de vários compostos, inclusive aminas, álcoois e outros derivados de organossilício. Ele serve principalmente como um reagente para a proteção seletiva de álcoois, aminas e grupos funcionais na síntese orgânica. Além disso, o trifluorometanosulfonato de terc-butildimetilsilil desempenha um papel crucial na síntese de peptídeos e no desenvolvimento de moléculas biologicamente ativas. Além disso, ele facilita a síntese de uma série de compostos de organossilício, como silanos, siloxanos e silanos. O trifluorometanosulfonato de terc-butildimetilsilil atua como um nucleófilo, visando centros eletrofílicos em moléculas orgânicas. A reação ocorre rapidamente e o produto resultante é normalmente isolado por destilação. É importante observar que o trifluorometanosulfonato de terc-butildimetilsilil não apresenta efeitos bioquímicos ou fisiológicos significativos. Ele é considerado atóxico, não causando reações adversas em humanos ou animais.
tert-Butyldimethylsilyl trifluoromethanesulfonate (CAS 69739-34-0) Referencias
- Ribonucleósidos com ramificação 2'-C: Síntese dos Derivados Fosforamidíticos da 2'-C-beta-Metilcitidina e sua Incorporação em Oligonucleótidos. | Tang, XQ., et al. 1999. J Org Chem. 64: 747-754. PMID: 11674142
- Síntese melhorada de derivados de 5-hidroxilisina (Hyl). | Cudic, M., et al. 2005. J Pept Res. 65: 272-83. PMID: 15705169
- Uma via enantioselectiva convergente para antibióticos 6-deoxitetraciclina estruturalmente diversos. | Charest, MG., et al. 2005. Science. 308: 395-8. PMID: 15831754
- Síntese de produtos naturais biologicamente activos e de compostos de referência para novos fármacos através da construção eficaz de um esqueleto policíclico. | Ihara, M. 2006. Chem Pharm Bull (Tokyo). 54: 765-74. PMID: 16755041
- Alquilação radical de derivados de bis(sililoxi)enamina de compostos nitro orgânicos. | Lee, JY., et al. 2006. Angew Chem Int Ed Engl. 45: 6182-6. PMID: 16906611
- Síntese e atividade antibacteriana de derivados de eritromicina A do tipo 3-ceto-6-O-carbamoil-11,12-tiocarbamato cíclico. | Zhu, B., et al. 2007. Bioorg Med Chem Lett. 17: 3900-4. PMID: 17502142
- Síntese e aplicação em fase sólida de blocos de construção de gama-hidroxivalina adequadamente protegidos. | Cudic, M., et al. 2007. J Org Chem. 72: 5581-6. PMID: 17583956
- Síntese de análogos de nostoclídeos inibidores da fotossíntese. | Teixeira, RR., et al. 2008. J Agric Food Chem. 56: 2321-9. PMID: 18338868
- Síntese total da D-chalcose e do seu epímero C-3. | Sun, J., et al. 2013. Beilstein J Org Chem. 9: 2620-4. PMID: 24367425
- Rearranjo de um Vinilideno de Ouro Transiente em Carbenos de Ouro. | Debrouwer, W. and Fürstner, A. 2017. Chemistry. 23: 4271-4275. PMID: 28230280
- Perfil dos componentes e metabolitos de Vaccinium macrocarpon na urina humana e o efeito ex-vivo da urina na adesão de Candida albicans e na formação de biofilme. | Baron, G., et al. 2020. Biochem Pharmacol. 173: 113726. PMID: 31778647
- Síntese e reacções de carbamatos de sililo. 1. Transformação quimiosselectiva de grupos protectores amino através de carbamatos de terc-butildimetilsililo | Masahiro Sakaitani and Yasufumi Ohfune. 1990,. J. Org. Chem. 55, 3,: 870–876.
- Reação do tiofenol com epóxidos de glucal: Estrutura de raios X do 3,4,6-tri-O-terc-butildimetilsilil-1-S-fenil-1-tio-α-D-glucopiranosídeo | . 1997,. Chem. Commun.,. 1855-1856.
Informacoes sobre ordens
| Nome do Produto | Numero de Catalogo | UNID | Preco | Qde | FAVORITOS | |
tert-Butyldimethylsilyl trifluoromethanesulfonate, 1 g | sc-251141 | 1 g | $28.00 | |||
tert-Butyldimethylsilyl trifluoromethanesulfonate, 5 g | sc-251141A | 5 g | $62.00 | |||
tert-Butyldimethylsilyl trifluoromethanesulfonate, 100 g | sc-251141B | 100 g | $118.00 | |||
tert-Butyldimethylsilyl trifluoromethanesulfonate, 500 g | sc-251141C | 500 g | $407.00 |
