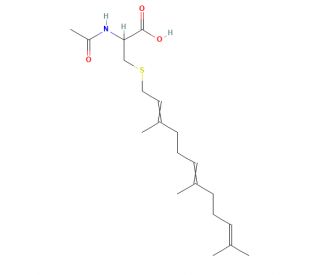
N-Acetyl-S-farnesyl-L-cysteine (AFC) (CAS 135304-07-3)
LINK RAPIDI
La N-acetil-S-farnesil-L-cisteina (AFC) è un amminoacido cisteina derivato sinteticamente che inibisce gli enzimi carbossil-metiltransferasi della S-farnesil-cisteina. Questi enzimi riconoscono la N-acetil-S-farnesil-L-cisteina (AFC) come substrato attraverso la parte farnesilica e l'occupazione del sito di legame blocca l'elaborazione delle proteine farnesilate da parte dell'enzima. La carbossimetilazione delle proteine farnesilate è un'importante modifica che regola la funzione delle proteine. Il blocco dell'elaborazione metiltransferasica delle proteine rap1 piastriniche da parte della N-acetil-S-farnesil-L-cisteina (AFC) porta all'inibizione dell'aggregazione piastrinica. La N-acetil-S-farnesil-L-cisteina (AFC) è descritta anche per bloccare il movimento cellulare e l'adesione alla membrana delle proteine Ras interferendo con l'elaborazione della metilazione carbossilica. L'N-acetil-S-farnesil-L-cisteina (AFC) come substrato per la metiltransferasi proteica isoprenilata è descritta per bloccare il rilascio di anione radicale superossido stimolato da fMet-Leu-Phe nelle cellule neutrofile. L'inibizione della chemiotassi dei neutrofili da parte della N-acetil-S-farnesil-L-cisteina (AFC) produce anche la soppressione della risposta infiammatoria indotta dal 12-O-tereadecanoil-forbolo-13-acetato e dall'acido arachidonico.
N-Acetyl-S-farnesyl-L-cysteine (AFC) (CAS 135304-07-3) Referenze
- La metilazione carbossilica di Ras regola il targeting di membrana e l'ingaggio di effettori. | Chiu, VK., et al. 2004. J Biol Chem. 279: 7346-52. PMID: 14660603
- Stimolazione dell'attività di Rac1 da parte del fattore di necrosi tumorale alfa. Ruolo dell'isoprenilcisteina carbossimetiltransferasi. | Papaharalambus, C., et al. 2005. J Biol Chem. 280: 18790-6. PMID: 15647276
- Meccanismo cinetico della metiltransferasi proteica isoprenilata. | Shi, YQ. and Rando, RR. 1992. J Biol Chem. 267: 9547-51. PMID: 1577795
- Analoghi amidico-sostituiti della farnesilcisteina come inibitori dell'isoprenilcisteina carbossil metiltransferasi umana. | Donelson, JL., et al. 2006. Bioorg Med Chem Lett. 16: 4420-3. PMID: 16777414
- La N-acetil-S-farnesil-L-cisteina topica inibisce l'infiammazione cutanea dei topi e, a differenza del desametasone, i suoi effetti sono limitati al sito di applicazione. | Gordon, JS., et al. 2008. J Invest Dermatol. 128: 643-54. PMID: 17882268
- La carbossimetilazione delle proteine rap1 piastriniche è stimolata dalla guanosina 5'-(3-O-thio)trifosfato. | Huzoor-Akbar, ., et al. 1991. J Biol Chem. 266: 4387-91. PMID: 1900293
- Reazioni di metilazione e demetilazione delle proteine leganti il nucleotide guanina dei segmenti esterni dei bastoncelli retinici. | Pérez-Sala, D., et al. 1991. Proc Natl Acad Sci U S A. 88: 3043-6. PMID: 1901651
- Identificazione dell'unità di riconoscimento per la metilazione delle proteine G. | Tan, EW., et al. 1991. J Biol Chem. 266: 10719-22. PMID: 1904056
- Effetti degli analoghi della farnesilcisteina sulla carbossimetilazione delle proteine e sulla trasduzione del segnale. | Volker, C., et al. 1991. J Biol Chem. 266: 21515-22. PMID: 1939182
- Analoghi della prenilcisteina sostituiti da lipidi e zolfo come inibitori dell'Icmt umano. | Bergman, JA., et al. 2011. Bioorg Med Chem Lett. 21: 5616-9. PMID: 21782433
- La N-acetil-S-farnesil-l-cisteina sopprime la produzione di chemochine da parte delle cellule endoteliali microvascolari cutanee umane. | Adhami, K., et al. 2012. Exp Dermatol. 21: 700-5. PMID: 22897577
- Studi meccanici sulla metiltransferasi delle proteine isoprenilate delle piastrine umane: gli analoghi della farnesilcisteina bloccano l'aggregazione piastrinica senza inibire la metiltransferasi. | Ma, YT., et al. 1994. Biochemistry. 33: 5414-20. PMID: 8180165
- Gli analoghi della farnesil-L-cisteina possono inibire o avviare il rilascio di superossido da parte dei neutrofili umani. | Ding, J., et al. 1994. J Biol Chem. 269: 16837-44. PMID: 8207006
- L'analogo della proteina prenilcisteina inibisce la trasduzione del segnale mediata dall'agonista-recettore nelle piastrine umane. | Huzoor-Akbar, ., et al. 1993. Proc Natl Acad Sci U S A. 90: 868-72. PMID: 8430099
- Metilazione carbossilica delle proteine Ras-correlate durante la trasduzione del segnale nei neutrofili. | Philips, MR., et al. 1993. Science. 259: 977-80. PMID: 8438158
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
N-Acetyl-S-farnesyl-L-cysteine (AFC), 5 mg | sc-200839 | 5 mg | $88.00 | |||
N-Acetyl-S-farnesyl-L-cysteine (AFC), 25 mg | sc-200839A | 25 mg | $230.00 |
