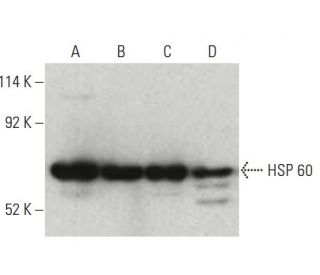


Anticorpo HSP 60 (24): sc-136291
- HSP 60 Antibody 24 è un monoclonale di topo IgG1 κ, citato in 12 pubblicazioni, fornito in 200 µg/ml
- generato contro gli amminoacidi 1-200 di HSP 60 di origine human
- HSP 60 Antibody (24) é raccomandato per il rilevamento di HSP60 di origine mouse, rat e human in WB, IP e IF
- Vedere HSP 60 (LK1): sc-59567 for HSP 60 per anticorpi coniugati, tra cui AC, HRP, FITC, PE, Alexa Fluor® 488, 594, 647, 680 e 790.
- m-IgGκ BP-HRP è il reagente secondario di rilevazione preferito per l'anticorpo HSP 60 (24) per applicazioni WB. Questo reagente è ora offerto in combinazione con l'anticorpo HSP 60 (24)(vedere le informazioni per l'ordine sotto). Per ulteriori coniugati m-IgGκ BP, consultare l'elenco completo delle proteine leganti le IgG di topo.
Le proteine da shock termico (HSP) comprendono un gruppo di proteine altamente conservate e abbondantemente espresse con diverse funzioni, tra cui l'assemblaggio e il sequestro di complessi multiproteici, il trasporto di catene polipetidiche nascenti attraverso le membrane cellulari e la regolazione del ripiegamento delle proteine. Le HSP (note anche come chaperoni molecolari) si dividono in sei famiglie generali: HSP 90, HSP 70, HSP 60, le HSP a basso peso molecolare, le immunofiline e la famiglia HSP 110. La proteina mitocondriale HSP 60, espressa in modo costitutivo, condivide con gli altri membri della famiglia HSP la capacità di riconoscere e stabilizzare le proteine durante il ripiegamento, l'assemblaggio e il disassemblaggio. La localizzazione mitocondriale e citosolica di HSP 60, insieme al suo legame e alla catalisi del ripiegamento delle proteine di nuova sintesi destinate alla matrice mitocondriale, classificano questa proteina come chaperone molecolare. Un ulteriore ruolo di HSP 60 è quello di agire come marcatore della superficie cellulare per il riconoscimento delle cellule T γ/δ.
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
HSP 60 Anticorpo (24) | sc-136291 | 200 µg/ml | $322.00 | |||
HSP 60 (24): m-IgGκ BP-HRP Bundle | sc-521352 | 200 µg Ab, 40 µg BP | $361.00 |

