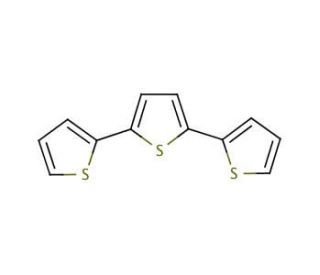
2,2′:5′,2′′-Terthiophene (CAS 1081-34-1)
LINK RAPIDI
Il 2,2':5',2''-Tertiofene (2,2':5',2''-TTP) è un membro della famiglia dei composti organici del tiofene. La sua struttura unica è caratterizzata da un anello a cinque membri che collega due atomi di zolfo e un anello a due membri che collega due atomi di ossigeno. Ampiamente studiato per le sue notevoli caratteristiche, il 2,2':5',2''-Tertiofene presenta un'elevata solubilità nei solventi organici, che lo rende di grande interesse per potenziali applicazioni nell'elettronica organica e nell'optoelettronica.Nel regno dell'elettronica organica e dell'optoelettronica, il 2,2':5',2''-Tertiofene occupa un posto di primo piano. È un materiale attivo fondamentale in dispositivi come i transistor organici a effetto di campo (OFET), i diodi organici a emissione di luce (OLED) e le celle fotovoltaiche organiche (OPV). Svolge un ruolo fondamentale nello sviluppo di sensori, in particolare di sensori elettrochimici, in grado di rilevare diverse sostanze come il glucosio, l'ammoniaca e l'ossido nitrico. Una delle sue caratteristiche principali è la capacità di agire come donatore di elettroni, facilitando forti interazioni con altre molecole, in particolare quelle che si incontrano nel campo dell'elettronica organica e dell'optoelettronica.
2,2′:5′,2′′-Terthiophene (CAS 1081-34-1) Referenze
- Trasformazioni fotoindotte in film sottili di 2,2':5',2''-tertiofene su argento. | Alaverdyan, Y., et al. 2006. Phys Chem Chem Phys. 8: 1445-50. PMID: 16633627
- sintesi elettive ed efficienti di derivati fototossici del 2, 2′: derivati del 5′, 2 ″tertiofene″ con un sostituente funzionale in posizione 3′ o 5 | Rossi, R., Carpita, A., Ciofalo, M., & Lippolis, V. 1991. Tetrahedron. 47(39): 8443-8460.
- Attraversamento intersistemico singoletto-tripletto in 2, 2′: 5′, 2 ″tertiofene e alcuni suoi derivati. | Rossi, R., Ciofalo, M., Carpita, A., & Ponterini, G. 1993. Journal of Photochemistry and Photobiology A: Chemistry. 70(1): 59-67.
- Studio meccanicistico della fotossidazione dello squalene sensibilizzato con 2, 2′: 5′, 2 ″-Tertiofene e 2, 2′-Bitiofene | Fujita, H., Tokiwa, K., Sayama, K., Mori, H., & Sasaki, M. 1993. Bulletin of the Chemical Society of Japan. 66(10): 2960-2964.
- Reazioni di addizione ossidativa di 2, 2′-bitiofene e 2, 2′: 5′, 2 ″-tertiofene con cluster trinucleari di ferro, rutenio e osmio | Arce, A. J., Arrojo, P., De Sanctis, Y., Márquez, M., & Deeming, A. J. 1994. Journal of organometallic chemistry. 479(1-2): 159-164.
- Studio teorico del 2, 2′; 5′, 2 ″tertiofene (α-T) e dei suoi analoghi. Parte 1. Correlazione della struttura elettronica e delle energie con la fototossicità erbicida | Friedman, D. C., & Friedman, P. 1995. Journal of Molecular Structure: THEOCHEM,. 333(1-2): 71-78.
- Indagini teoriche sui difetti bipolaronici positivi negli oligotiofeni: Strutture e spettri vibrazionali di 2,2′-bitiofene doppiamente carico e 2,2′:5′,2″-tertiofene | Ehrendorfer, C., & Karpfen, A. 1995. Vibrational Spectroscopy. 8(2): 293-303.
- Spettri stazionari e risolti nel tempo di 2, 2′: 5′, 2 ″tertiofene | Yang, A., Hughes, S., Kuroda, M., Shiraishi, Y., & Kobayashi, T. 1997. Chemical physics letters. 280(5-6): 475-480.
- Nuovi derivati difenilfosfini del 2,2′-bitiofene, del 2,2′:5′,2″-tertiofene, della 2-(2′-thienil)piridina e della 2,6-di-2′-thienilpiridina. Strutture cristalline di 5,5′-bis(difenilfosfino)-2,2′-bitiofene, difenil{5-[6′-(difenilfosfino)-2′-piridile]-2-thienil}fosfina e 2,6-bis[5′-(difenilfosfino)-2′-thienil]piridina | Field, J. S., Haines, R. J., Lakoba, E. I., & Sosabowski, M. H. 2001. Journal of the Chemical Society, Perkin Transactions 1. (24): 3352-3360.
- Elettrolimerizzazione di 2,2′:5′,2″ tertiofene in un'interfaccia liquido-liquido elettrificata | Gorgy, K., Fusalba, F., Evans, U., Kontturi, K., & Cunnane, V. J. 2001. Synthetic metals. 125(3): 365-373.
- Studio spettroelettrochimico della polimerizzazione di 2,2':5',2''-Tertiofene in un'interfaccia liquido/liquido controllata da ioni determinanti il potenziale | Evans-Kennedy, U., Clohessy, J., & Cunnane, V. J. 2004. Macromolecules. 37(10): 3630-3634.
- Copolimerizzazione elettrochimica di carbazolo e 2, 2′: 5′-2 ″tertiofene: caratterizzazione e applicazione a microcondensatori | Ates, M., & Eren, N. 2014. Iranian Polymer Journal. 23: 581-589.
- Deposizione di vapore assistita da liquido ionico e controllo dei polimorfi di cristalli di 2, 2′: cristalli di 5′, 2 ″tertiofene | Okawara, K., Maruyama, S., & Matsumoto, Y. 2019. Japanese Journal of Applied Physics. 58(8): 085503.
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
2,2′:5′,2′′-Terthiophene, 1 g | sc-256272 | 1 g | $112.00 |
