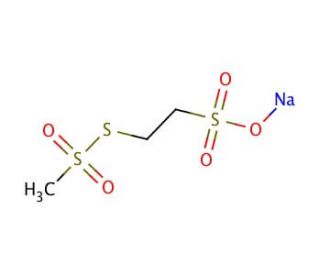
Sodium (2-Sulfonatoethyl)methanethiosulfonate (CAS 184644-83-5)
Vedere citazioni di prodotto (1)
LINK RAPIDI
Il sodio (2-solfonatoetil)metanethiosolfonato è una sonda per i canali dei recettori GABAA. Come metanethiosolfonato, il sodio (2-solfonatoetil)metanethiosolfonato è sulfidrilico-reattivo e può essere usato per studiare i residui di cisteina sulle proteine. Il sodio (2-solfonatoetil)metanethiosolfonato reagisce in modo specifico e rapido con i tioli per formare disolfuri misti. Il sodio (2-solfonatoetil)metanethiosolfonato sonda le strutture del canale del recettore ACh del canale del recettore GABAA e della lattosio permeasi. Il sodio (2-solfonatoetil)metanethiosolfonato è particolarmente efficace nel sondare le proteine native associate alle membrane, come i canali e i trasportatori.
Sodium (2-Sulfonatoethyl)methanethiosulfonate (CAS 184644-83-5) Referenze
1. Dunten, R.L., et al.: Biochem., 32, 3139 (1993),2. Yang, N. et al.: Neuron, 16, 113 (1996),
3. Holmgren, M., et al: Neuropharmacology, 35, 797 (1996),
4. Chahine, M., et al.: Biochem. Bio. Res. Commun., 233, 606 (1997),
5. Ehrlich, B.E., et al.: J. Gen. Physiol., 109, 255 (1997),
6. Lang, R.J., Harvey, J.R., and Mulholland, E.L.Sodium (2-sulfonatoethyl) methanethiosulfonate prevents S-nitroso-L-cysteine activation of Ca2+-activated K+ (BKCa) channels in myocytes of the guinea-pig taenia caeca. Br. J. Pharmacol. 139(6), 1153-1163 (2003).
7. Li, R.A., Tsushima, R.G., Kallen, R.G., et al.Pore residues critical for μ-CTX binding to rat skeletal muscle Na+ channels revealed by cysteine mutagenesis. Biophys. J. 73(4), 1874-1884 (1997).
8. Guan, L., and Kaback, H.R.Site-directed alkylation of cysteine to test solvent accessibility of membrane proteins. Nature Protocols 2(8), 2012-2017 (2007).
9. Engh, A.M., and Maduke, M.Cysteine accessibility in ClC-0 supports conservation of the ClC intracellular vestibule. Journal of General Physiology 125(6), 601-617 (2014).
10. Liu, X., Alexander, C., Serrano, J., et al.Variable reactivity of an engineered cysteine at position 338 in cystic fibrosis transmembrane conductance regulator reflects different chemical states of the thiol. The Journal of Biological Chemisty 281(12), 8275-8285 (2006).
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
Sodium (2-Sulfonatoethyl)methanethiosulfonate, 250 mg | sc-212933 | 250 mg | $370.00 |
