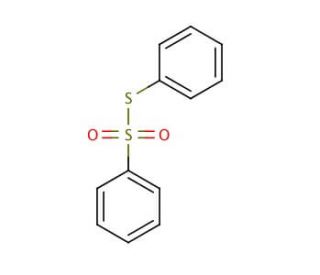
S-Phenyl benzenethiosulfonate (CAS 1212-08-4)
LINK RAPIDI
L'S-fenilbenzeniosolfonato è solubile in acqua, alcol e vari solventi organici. La sua natura versatile gli consente di servire molteplici scopi, tra cui l'etichettatura di proteine e peptidi, l'utilizzo di substrati enzimatici e l'impiego come reagente nella sintesi organica. Trova inoltre applicazione nello studio della struttura e della funzionalità delle proteine e di altre molecole biologiche, nonché nello studio dell'impatto di farmaci e tossine sui sistemi cellulari. Si propone che l'S-fenilbenzeniosolfonato funzioni come substrato per gli enzimi e si impegni in interazioni con le proteine e altri costituenti cellulari. Si ipotizza che queste interazioni coinvolgano interazioni elettrostatiche, legami a idrogeno e interazioni con altre molecole cellulari.
S-Phenyl benzenethiosulfonate (CAS 1212-08-4) Referenze
- Sintesi catalizzata da ioduro di tiocarbammati secondari da isocianuri e tiosolfonati. | Mampuys, P., et al. 2016. Org Lett. 18: 2808-11. PMID: 27276236
- Attivazione delle ammine: Sintesi di N-(Etero)arilammidi da isotiouree e acidi carbossilici. | Zhu, YP., et al. 2016. Org Lett. 18: 4602-5. PMID: 27570902
- Sintesi di ammidi secondarie da tiocarbammati. | Mampuys, P., et al. 2018. Org Lett. 20: 4235-4239. PMID: 29975068
- Identificazione gascromatografica-spettrometrica di massa del cianuro mediante una derivatizzazione basata sulla sostituzione nucleofila con S-fenilbenzeniosolfonato. | Goud, DR., et al. 2020. Anal Methods. 12: 5839-5845. PMID: 33227115
- Sintesi promossa dalla luce visibile di tiocarbammati secondari e terziari da tiosolfonati e formammidi N-sostituite. | Bi, WZ., et al. 2021. Org Biomol Chem. 19: 8701-8705. PMID: 34590107
- Solfenilazione fotoeccitata di legami C(sp3)-H in ammidi mediante tiosolfonati. | Bi, WZ., et al. 2022. Org Biomol Chem. 20: 3902-3906. PMID: 35502883
- Solfuro di fenile trifluorovinile: un accettore di radicali per la preparazione di composti gem-difluorometilenici | Okano, T., Chokai, M., Hiraishi, M., Yoshizawa, M., Kusukawa, T., & Fujita, M. 2004. Tetrahedron. 60(18): 4031-4035.
- Ossidazione di solfuri e disolfuri organici con un sistema terz-butilidroperossido-alluminio tri-terz-butossido | Zaburdaeva, E. A., & Dodonov, V. A. 2011. Russian Chemical Bulletin. 60: 185-187.
- Struttura molecolare e vibrazionale degli S-esteri di tiosolfonato | TXT Luu, F Duus, J Spanget-Larsen. 2013. Journal of Molecular Structure. 1049: 165-171.
- Attivazione delle ammine: Sintesi di ammidi di N-arilamminoacidi da isotiouree e amminoacidi | Zhu, Y. P., Mampuys, P., Sergeyev, S., Ballet, S., & Maes, B. U. 2017. Advanced Synthesis & Catalysis. 359(14): 2481-2498.
- Effetto del solvente sulla riduzione elettrochimica del S-fenilbenzeniosolfonato | Hamed, E. M. 2018. Research on Chemical Intermediates. 44: 1847-1864.
- Sintesi di vinil-solfoni attraverso solfonilazioni alcheniche mediate da I2 con tiosolfonati | Hwang, S. J., Shyam, P. K., & Jang, H. Y. 2018. Bulletin of the Korean Chemical Society. 39(4): 535-539.
- Ciclizzazione tandem ossidativa senza ossidanti esterni: Tiolazione catalizzata da NaI per la sintesi di pirroli 3-tiosostituiti | and Bingxiang Yuan, Yong Jiang, Zhenjie Qi, Xin Guan, Ting Wang, Rulong Yan. 2019. Advanced Synthesis & Catalysis. 361(22): 5112-5117.
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
S-Phenyl benzenethiosulfonate, 1 g | sc-229161 | 1 g | $209.00 |
