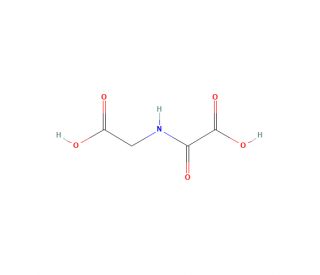
N-Oxalylglycine (CAS 5262-39-5)
Vedere citazioni di prodotto (5)
LINK RAPIDI
La N-Oxalilglicina è un composto che funziona come inibitore competitivo delle diossigenasi 2-ossoglutarato-dipendenti. Agisce chelando il ferro del sito attivo, impedendo così il legame del co-substrato e inibendo l'attività enzimatica. Il meccanismo d'azione della N-Oxalilglicina prevede l'interruzione del ciclo catalitico delle diossigenasi 2-ossoglutarato-dipendenti, coinvolte in vari processi biologici come la demetilazione del DNA e degli istoni e le vie di risposta all'ipossia. Interferendo con l'attività enzimatica di queste diossigenasi, la N-Oxalilglicina può essere utilizzata per studiare il ruolo specifico di questi enzimi nei processi cellulari e nelle vie di segnalazione. La sua capacità di inibire competitivamente il ferro del sito attivo può essere utile per studiare i meccanismi molecolari alla base delle funzioni delle diossigenasi dipendenti dal 2-ossoglutarato in varie applicazioni sperimentali.
N-Oxalylglycine (CAS 5262-39-5) Referenze
- Indagine cinetica e spettroscopica dell'inibizione da parte di CoII, NiII e N-ossalilglicina della FeII/alfa-chetoglutarato diossigenasi, TauD. | Kalliri, E., et al. 2005. Biochem Biophys Res Commun. 338: 191-7. PMID: 16165092
- Sintesi e attività della N-ossalilglicina e dei suoi derivati come inibitori della demetilasi della lisina istone contenente il dominio C di Jumonji. | Hamada, S., et al. 2009. Bioorg Med Chem Lett. 19: 2852-5. PMID: 19359167
- Evidenza della mancanza di una soppressione trascrizionale diretta del peptide regolatore del ferro epcidina da parte dei fattori inducibili dall'ipossia. | Volke, M., et al. 2009. PLoS One. 4: e7875. PMID: 19924283
- Progettazione del campo di forza e simulazioni di dinamica molecolare del fattore inibitore HIF-1 e del suo complesso con inibitori noti: implicazioni per la progettazione di inibitori razionali. | Park, H., et al. 2010. J Mol Graph Model. 29: 221-8. PMID: 20663694
- L'inibitore della 2-ossoglutarato ossigenasi ad ampio spettro N-ossalilglicina è presente nelle foglie di rabarbaro e spinaci. | Al-Qahtani, K., et al. 2015. Phytochemistry. 117: 456-461. PMID: 26196940
- Nuova strategia elettrochimica priva di etichette per la determinazione sensibile della proteina 1 di traslocazione Ten-Eleven. | Yu, Z., et al. 2021. Anal Chim Acta. 1146: 140-145. PMID: 33461709
- Una nuova serie di inibitori putativi dell'istone demetilasi di Brugia malayi come potenziali farmaci antifilari. | Kreiss, T., et al. 2022. PLoS Negl Trop Dis. 16: e0010216. PMID: 35294431
- Conservazione dell'insolito ripiegamento dimerico JmjC di JMJD7 dalla Drosophila melanogaster all'uomo. | Chowdhury, R., et al. 2022. Sci Rep. 12: 6065. PMID: 35410347
- Correzione dell'editore: Analoghi del MOG per esplorare il farmacoforo dell'MCT2, la biologia dell'α-chetoglutarato e gli effetti cellulari della N-ossalilglicina. | Fets, L., et al. 2022. Commun Biol. 5: 1019. PMID: 36167803
- Analisi strutturale del sito di legame del 2-ossoglutarato dell'ossigenasi JMJD5 legata al ritmo circadiano. | Islam, MS., et al. 2022. Sci Rep. 12: 20680. PMID: 36450832
- Un high-throughput effector screen identifica un nuovo scaffold di piccole molecole per l'inibizione della diossigenasi 2 a traslocazione ten-eleven. | Palei, S., et al. 2022. RSC Med Chem. 13: 1540-1548. PMID: 36545435
- La formaldeide reagisce con i residui di prolina N-terminali per dare aminali biciclici. | John, T., et al. 2023. Commun Chem. 6: 12. PMID: 36698022
- Selettività del substrato e inibizione delle idrossilasi di istidina JmjC MINA53 e NO66. | Türkmen, VA., et al. 2023. RSC Chem Biol. 4: 235-243. PMID: 36908702
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
N-Oxalylglycine, 10 mg | sc-202720 | 10 mg | $53.00 | |||
N-Oxalylglycine, 100 mg | sc-202720A | 100 mg | $153.00 |
