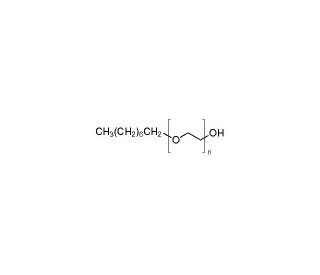
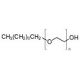
Struttura molecolare di n-Octyl-oligo-oxyethylene, Numero CAS: 27252-75-1
n-Octyl-oligo-oxyethylene (CAS 27252-75-1)
Nomi alternativi:
Octyl-POE
Applicazione:
n-Octyl-oligo-oxyethylene è un detergente utile per la solubilizzazione, la purificazione e la cristallizzazione delle proteine
Numero CAS:
27252-75-1
Formula molecolare:
C8H18O(C2H4O)n
Solo per uso in Ricerca. Non previsto per Uso Diagnostico o Terapeutico.
* Vedere Certificato di Analisi per informazioni sul lotto specifico (incluso il contenuto d'acqua).
LINK RAPIDI
Informazioni ordini
Descrizione
Informazione tecnica
Informazioni di sicurezza
SDS & Certificato d'analisi
Il n-ottil-oligo-ossietilene (2-OE) è un detergente per la solubilizzazione, la purificazione e la cristallizzazione delle proteine di membrana. Il n-ottil-oligo-ossietilene è utilizzato come solvente, tensioattivo ed emulsionante in molti prodotti industriali e di consumo, come prodotti per la pulizia, cosmetici e per la cura della persona. Viene anche utilizzato come reagente o catalizzatore nella sintesi organica e nella produzione di farmaci e coloranti. Inoltre, è stato dimostrato che riduce la viscosità del muco, ha effetti antinfiammatori e ha un effetto protettivo sulla pelle.
n-Octyl-oligo-oxyethylene (CAS 27252-75-1) Referenze
- Regioni del lipopolisaccaride coinvolte nell'attivazione della proteasi di membrana esterna OmpT di Escherichia coli. | Kramer, RA., et al. 2002. Eur J Biochem. 269: 1746-52. PMID: 11895445
- Le strutture cristalline spiegano le proprietà funzionali di due porine di E. coli. | Cowan, SW., et al. 1992. Nature. 358: 727-33. PMID: 1380671
- Il ruolo critico dei detergenti nella cristallizzazione delle proteine di membrana. | Rosenbusch, JP. 1990. J Struct Biol. 104: 134-8. PMID: 2088442
- Cristallizzazione e caratterizzazione preliminare ai raggi X della maltoporina di Escherichia coli. | Stauffer, KA., et al. 1990. J Mol Biol. 211: 297-9. PMID: 2137884
- Etichettatura topografica di proteine formanti pori della membrana esterna di Escherichia coli. | Page, MG. and Rosenbusch, JP. 1986. Biochem J. 235: 651-61. PMID: 2428354
- La struttura beta densamente impacchettata all'interfaccia proteina-lipide della porina è rivelata dalla microscopia crioelettronica ad alta risoluzione. | Sass, HJ., et al. 1989. J Mol Biol. 209: 171-5. PMID: 2553985
- Concentrazioni micellari critiche dei detergenti. | Zulauf, M., et al. 1989. Methods Enzymol. 172: 528-38. PMID: 2747541
- Le triplette di canali porinici si fondono in singole uscite nelle membrane esterne di Escherichia coli. | Engel, A., et al. Nature. 317: 643-5. PMID: 2997617
- Caratterizzazione della principale proteina dell'involucro di Escherichia coli. Disposizione regolare sul peptidoglicano e insolito legame con il dodecil-solfato. | Rosenbusch, JP. 1974. J Biol Chem. 249: 8019-29. PMID: 4609976
- Una nuova procedura per l'isolamento della proteina mielinica cerebrale in forma legata ai lipidi. | Riccio, P., et al. 1984. FEBS Lett. 177: 236-40. PMID: 6209168
- Topologia della proteina recettoriale del fago lambda. Mappatura dei bersagli del clivaggio proteolitico in relazione ai siti di legame per i fagi o gli anticorpi monoclonali. | Schenkman, S., et al. 1984. J Biol Chem. 259: 7570-6. PMID: 6234303
- La citocromo c ossidasi solubilizzata di Paracoccus denitrificans è un monomero. | Ludwig, B., et al. 1982. J Biol Chem. 257: 5576-8. PMID: 6279605
- L'unità regolatrice del GTP stimolante Ns e l'unità catalitica dell'adenilato ciclasi sono strettamente associate: conseguenze meccaniche. | Arad, H., et al. 1984. Proc Natl Acad Sci U S A. 81: 6579-83. PMID: 6436817
- Sistema di fosfotransferasi batteriche. Solubilizzazione e purificazione dell'enzima II specifico per il glucosio dalle membrane di Salmonella typhimurium. | Erni, B., et al. 1982. J Biol Chem. 257: 13726-30. PMID: 6754716
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
n-Octyl-oligo-oxyethylene, 5 ml | sc-286437 | 5 ml | $260.00 | |||
n-Octyl-oligo-oxyethylene, 25 ml | sc-286437A | 25 ml | $364.00 |
