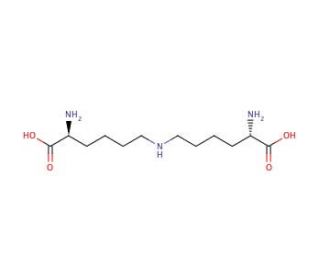
Lysinonorleucine (CAS 25612-46-8)
Vedere citazioni di prodotto (2)
LINK RAPIDI
La lisinonorleucina è un dipeptide che trova applicazione nella ricerca biochimica grazie al suo ruolo di biomarcatore del danno proteico, in particolare nello studio del cross-linking e della degradazione delle proteine. Viene utilizzato per valutare l'entità dell'ossidazione delle proteine e degli eventi di reticolazione in varie condizioni sperimentali, compresi gli studi sullo stress ossidativo e sull'invecchiamento in sistemi cellulari e tissutali. La presenza di lisinonorleucina nelle proteine è indicativa dei prodotti finali della glicazione avanzata (AGE), che i ricercatori analizzano per comprendere il processo di invecchiamento e gli effetti a lungo termine dell'iperglicemia nei sistemi biologici. Inoltre, la lisinonorleucina è coinvolta nell'elucidazione dei percorsi legati al turnover proteico e alle modifiche post-traslazionali, fornendo approfondimenti sui meccanismi cellulari per il mantenimento dell'integrità delle proteine. La sua quantificazione è essenziale anche nel campo della proteomica, dove contribuisce alla caratterizzazione di miscele proteiche complesse e all'identificazione di nuove interazioni proteina-proteina.
Lysinonorleucine (CAS 25612-46-8) Referenze
- Effetto dell'iper- e microgravità sui controlli post-traslazionali del collagene degli osteoblasti MC3T3-E1. | Saito, M., et al. 2003. J Bone Miner Res. 18: 1695-705. PMID: 12968680
- Differenze correlate all'intensità nella modificazione post-traslazionale del collagene negli osteoblasti MC3T3-E1 dopo l'esposizione a ultrasuoni pulsati a bassa e alta intensità. | Saito, M., et al. 2004. Bone. 35: 644-55. PMID: 15336600
- Un sistema modello a due componenti per studiare l'architettura dell'assemblaggio dell'elastina in vitro. | Mithieux, SM., et al. 2005. J Struct Biol. 149: 282-9. PMID: 15721582
- Riduzione del grado di mineralizzazione e dei legami crociati enzimatici del collagene e aumento della pentosidina indotta dalla glicazione nella corteccia del collo femorale in casi di frattura del collo femorale. | Saito, M., et al. 2006. Osteoporos Int. 17: 986-95. PMID: 16552468
- Ruolo dei legami crociati enzimatici e indotti dalla glicazione del collagene come determinante della qualità dell'osso in ratti WBN/Kob spontaneamente diabetici. | Saito, M., et al. 2006. Osteoporos Int. 17: 1514-23. PMID: 16770520
- Elastina e proteine associate all'elastina dell'aorta e del polmone dei suini. | Richmond, VL. 1990. Connect Tissue Res. 25: 131-7. PMID: 2175693
- Sintesi dei legami crociati del collagene nell'endotelio vascolare in coltura. | Levene, CI., et al. 1989. Br J Exp Pathol. 70: 621-6. PMID: 2605112
- Valutazione della reticolazione derivata dalla lisilossidasi nel cheratocono mediante cromatografia liquida/spettrometria di massa. | Takaoka, A., et al. 2016. Invest Ophthalmol Vis Sci. 57: 126-36. PMID: 26780316
- L'elastina è eterogeneamente reticolata. | Schräder, CU., et al. 2018. J Biol Chem. 293: 15107-15119. PMID: 30108173
- Le modificazioni dell'allisina perturbano la struttura e la mobilità della tropoelastina su scala locale e globale. | Ozsvar, J., et al. 2019. Matrix Biol Plus. 2: 100002. PMID: 33543005
- Nucleosidi e aminoacidi isolati dal Cordyceps sinensis proteggono dalla mielosoppressione indotta dalla ciclofosfamide nei topi. | Zhang, Y., et al. 2022. Nat Prod Res. 36: 6056-6059. PMID: 35188001
- Digestione dell'elastasi e analisi biochimica dell'elastina di un elastofibroma. | Nakamura, Y., et al. 1986. Cancer. 58: 1070-5. PMID: 3637115
- Sintesi della lisinonorleucina e analisi spettrometrica di massa della lisinonorleucina e della merodesmosina nel legamento bovino e nella membrana del guscio d'uovo. | Oishi, K., et al. 2023. Arch Biochem Biophys. 740: 109585. PMID: 37001748
- L'istone H1 è un substrato della lisil ossidasi e contiene residui endogeni di borotritide sodica. | Kagan, HM., et al. 1983. Biochem Biophys Res Commun. 115: 186-92. PMID: 6137217
- Rilevazione in cromatografia liquida ad alta prestazione a colonna singola e in fluorescenza di legami crociati immaturi, maturi e senescenti del collagene. | Saito, M., et al. 1997. Anal Biochem. 253: 26-32. PMID: 9356137
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
Lysinonorleucine, 5 mg | sc-207837 | 5 mg | $344.00 |
