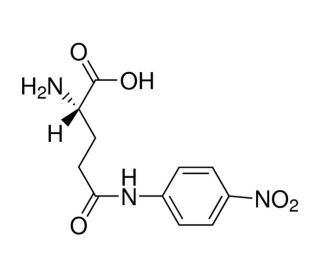
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6)
LINK RAPIDI
L'acido L-glutammico γ-(4-nitroanilide) è un composto che funge da substrato per l'enzima γ-glutamiltransferasi (GGT) in vari test biochimici. Quando viene utilizzato in applicazioni sperimentali, l'acido L-Glutammico γ-(4-nitroanilide) funge da substrato specifico per la GGT, consentendo di misurare l'attività della GGT in campioni biologici. In seguito all'interazione con la GGT, l'acido L-Glutammico γ-(4-nitroanilide) subisce una scissione enzimatica, con conseguente rilascio di 4-nitroanilina. Questa reazione può essere misurata quantitativamente con metodi spettrofotometrici, fornendo indicazioni sui livelli di attività della GGT nei sistemi biologici. Il meccanismo d'azione dell'acido L-Glutammico γ-(4-nitroanilide) prevede il suo riconoscimento specifico e la scissione da parte dell'enzima GGT, che porta alla generazione di un prodotto misurabile.
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6) Referenze
- Relazione non lineare di energia libera nell'acilazione catalizzata da un acido generale della gamma-glutamil transpeptidasi del rene di ratto con una serie di analoghi del substrato gamma-glutamil anilide. | Ménard, A., et al. 2001. Biochemistry. 40: 12678-85. PMID: 11601992
- La caratterizzazione della gamma-glutamiltranspeptidasi di Helicobacter pylori rivela le basi molecolari della specificità del substrato e un ruolo critico dell'anello contenente la tirosina 433 nella catalisi. | Morrow, AL., et al. 2007. Biochemistry. 46: 13407-14. PMID: 17960917
- La struttura cristallina della gamma-glutamiltranspeptidasi inibita dall'acivicina rivela il ruolo critico del suo C-terminus nell'autoelaborazione e nella catalisi. | Williams, K., et al. 2009. Biochemistry. 48: 2459-67. PMID: 19256527
- Proprietà biochimiche e strutturali della gamma-glutamil transpeptidasi di Geobacillus thermodenitrificans: un enzima specializzato nell'attività idrolasica. | Castellano, I., et al. 2010. Biochimie. 92: 464-74. PMID: 20138205
- Clonazione genica ed espressione proteica di γ-glutamiltranspeptidasi di Thermus thermophilus e Deinococcus radiodurans: confronto delle proprietà molecolari e strutturali con le controparti mesofile. | Castellano, I., et al. 2011. Extremophiles. 15: 259-70. PMID: 21298394
- Caratterizzazione di MtfA, una nuova proteina regolatrice del segnale di uscita del sistema glucosio-fosfotransferasi in Escherichia coli K-12. | Göhler, AK., et al. 2012. J Bacteriol. 194: 1024-35. PMID: 22178967
- γ-Glutamiltranspeptidasi: sequenza, struttura, proprietà biochimiche e applicazioni biotecnologiche. | Castellano, I. and Merlino, A. 2012. Cell Mol Life Sci. 69: 3381-94. PMID: 22527720
- Specificità del substrato donatore della gamma-glutamiltransferasi del rene bovino. | Agblor, AA. and Josephy, PD. 2013. Chem Biol Interact. 203: 480-5. PMID: 23500672
- Purificazione parziale e proprietà della gamma-glutamiltranspeptidasi da miceli di Morchella esculenta. | Moriguchi, M., et al. 1986. Arch Microbiol. 144: 15-9. PMID: 2870692
- Comportamento di L-gamma-glutamil-4-nitroanilide e L-gamma-glutamil-3-carbossi-4-nitroanilide nei confronti di gamma-glutamiltransferasi di diversa origine. | Verhoeff, PM., et al. 1988. Clin Chim Acta. 175: 129-34. PMID: 2900705
- Distribuzione e caratterizzazione funzionale del lisozima di tipo i di Apostichopus japonicus. | Li, C., et al. 2018. Fish Shellfish Immunol. 74: 419-425. PMID: 29079205
- Un bioinchiostro derivato da ECM renale fotoreticolabile accelera la formazione di tessuto renale. | Ali, M., et al. 2019. Adv Healthc Mater. 8: e1800992. PMID: 30725520
- Biodistribuzione del rame dopo somministrazione sistemica acuta di gluconato di rame a ratti. | García-Martínez, BA., et al. 2021. Biometals. 34: 687-700. PMID: 33900531
- Tridegina, un nuovo inibitore peptidico del fattore XIIIa, proveniente dalla sanguisuga Haementeria ghilianii. | Finney, S., et al. 1997. Biochem J. 324 (Pt 3): 797-805. PMID: 9210403
- Analisi delle proprietà cinetiche della gamma-glutamil transpeptidasi del rene di ratto. | Dvoráková, L., et al. 1996. Gen Physiol Biophys. 15: 403-13. PMID: 9228521
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
L-Glutamic acid γ-(4-nitroanilide), 1 g | sc-250219 | 1 g | $48.00 |
