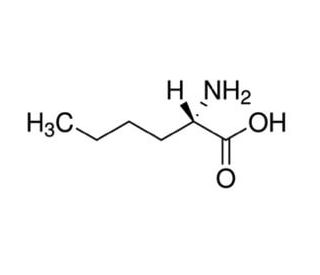
L-(+)-Norleucine (CAS 327-57-1)
LINK RAPIDI
La L-(+)-Norleucina è un aminoacido non proteinogenico che funziona come analogo strutturale della leucina. Può essere utilizzata per studiare gli effetti delle sostituzioni aminoacidiche sulla struttura e sulla funzione delle proteine. La L-(+)-Norleucina può essere incorporata in peptidi e proteine durante la sintesi chimica per studiare l'impatto della composizione aminoacidica alterata sull'attività biologica. Il suo meccanismo d'azione prevede l'interazione con i macchinari cellulari responsabili della sintesi proteica, influenzando potenzialmente il ripiegamento, la stabilità e l'attività delle molecole risultanti. La sua presenza nei sistemi sperimentali consente di studiare gli effetti delle modifiche degli amminoacidi sul comportamento e sulle proprietà delle proteine, contribuendo alla comprensione delle relazioni struttura-funzione nelle molecole biologiche.
L-(+)-Norleucine (CAS 327-57-1) Referenze
- Complessi ternari di cis-(NH(3))(2)PtCl(2) (cis-DDP) con guanosina (guo), citidina (cyd) e gli amminoacidi glicina (gly), L-alanina (ala), acido L-2-aminobutirrico (2-aba), L-norvalina (nval) e L-norleucina (nleu). | Katsarou, E., et al. 1997. Met Based Drugs. 4: 57-63. PMID: 18475769
- La L-leucina 5-idrossilasi di Nostoc punctiforme è un nuovo tipo di diossigenasi dipendente da Fe(II)/α-chetoglutarato, utile come biocatalizzatore. | Hibi, M., et al. 2013. Appl Microbiol Biotechnol. 97: 2467-72. PMID: 22584432
- Degradazione della lisina in Candida. Caratterizzazione e probabile ruolo delle aminotransferasi L-norleucina-leucina, 4-aminobutirrato e delta-aminovalerato:2-ossoglutarato. | Der Garabedian, PA. and Vermeersch, JJ. 1989. Biochimie. 71: 497-503. PMID: 2503054
- Struttura cristallina della forma mutante Cys115His della metionina γ-liasi di Citrobacter freundii complessata con l-norleucina. | Revtovich, SV., et al. 2017. Biochim Biophys Acta Proteins Proteom. 1865: 1123-1128. PMID: 28602917
- α-aminazione formale biocatalitica enantioselettiva dell'acido esanoico a l-norleucina. | Dennig, A., et al. 2018. Org Biomol Chem. 16: 8030-8033. PMID: 30334043
- Identificazione dell'incommensurabilità nella L-leucina: le instabilità reticolari possono essere considerate come fenomeni generali negli amminoacidi idrofobici? | Guinet, Y., et al. 2022. Phys Chem Chem Phys. 24: 27023-27030. PMID: 35946565
- Candida L-norleucina, leucina:2-ossoglutarato aminotransferasi. Purificazione e proprietà. | Der Garabedian, PA. and Vermeersch, JJ. 1987. Eur J Biochem. 167: 141-7. PMID: 3622507
- Sul ruolo degli aminoacidi a catena ramificata nel turnover proteico del muscolo scheletrico. Studi in vivo con la L-norleucina. | Schott, KJ., et al. 1985. Z Naturforsch C Biosci. 40: 427-37. PMID: 3895764
- Studi 1H NMR delle reazioni di scambio di idrogeno con il substrato catalizzate dalla L-metionina gamma-liasi. | Esaki, N., et al. 1985. Biochemistry. 24: 3857-62. PMID: 4052371
- Il rilascio di insulina indotto da leucina e norleucina dipende dall'attività delle aminotransferasi degli aminoacidi? | Sener, A., et al. 1983. J Biol Chem. 258: 6693-4. PMID: 6343380
- Inibizione da parte di L-valina e L-norleucina del rilascio di insulina indotto dal 3-fenilpiruvato. | Sener, A. and Malaisse, WJ. 1984. Biochimie. 66: 353-60. PMID: 6380597
- Il [3H]gabapentin può marcare un trasportatore di aminoacidi neutri simile al sistema-L nel cervello. | Thurlow, RJ., et al. 1993. Eur J Pharmacol. 247: 341-5. PMID: 8307106
- Proprietà conformazionali delle catene laterali di L-leucina, L-isoleucina e L-norleucina nei copolimeri di L-lisina. | Arfmann, HA., et al. 1977. Biopolymers. 16: 1815-26. PMID: 890071
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
L-(+)-Norleucine, 100 mg | sc-300860 | 100 mg | $20.00 |
