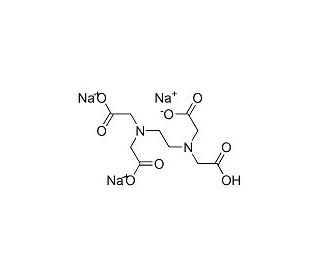
EDTA, 0.5 M, pH 8.0 (CAS 60-00-4)
Vedere citazioni di prodotto (7)
LINK RAPIDI
L'acido etilendiamminotetraacetico (EDTA) è un composto chimico versatile ampiamente utilizzato nella ricerca scientifica grazie alle sue eccezionali proprietà chelanti. Nei laboratori viene comunemente preparato in una soluzione 0,5 M con un pH pari a 8,0. Nella ricerca, l'EDTA viene impiegato principalmente come agente chelante, ovvero forma complessi stabili con gli ioni metallici. Questa proprietà lo rende prezioso in varie applicazioni biochimiche e di biologia molecolare. Ad esempio, l'EDTA è spesso utilizzato in biologia molecolare per chelare cationi divalenti come il magnesio (Mg^2+), essenziali per le polimerasi degli acidi nucleici. Sequestrando questi ioni, l'EDTA inibisce l'attività enzimatica, consentendo ai ricercatori di manipolare e studiare gli acidi nucleici senza reazioni enzimatiche indesiderate. Inoltre, l'EDTA trova ampio impiego nella chimica analitica, in particolare nella rilevazione e nelle titolazioni degli ioni metallici. La sua capacità di legarsi selettivamente a specifici ioni metallici consente di determinare e quantificare con precisione i metalli in miscele complesse. Oltre al suo ruolo di chelante, l'EDTA funge da agente stabilizzante in vari reagenti e soluzioni di laboratorio. La sua capacità di prevenire la catalisi o la degradazione mediata da ioni metallici aumenta la stabilità e la durata di molti reagenti biochimici e di biologia molecolare.
EDTA, 0.5 M, pH 8.0 (CAS 60-00-4) Referenze
- Relazione finale sulla valutazione della sicurezza di EDTA, EDTA disodico di calcio, EDTA diammonico, EDTA dipotassico, EDTA disodico, TEA-EDTA, EDTA tetrasodico, EDTA tripotassico, EDTA trisodico, HEDTA e HEDTA trisodico. | Lanigan, RS. and Yamarik, TA. 2002. Int J Toxicol. 21 Suppl 2: 95-142. PMID: 12396676
- Ulteriori osservazioni sull'interazione dell'EDTA con il sistema miosina-ATP. | FRIESS, EG., et al. 1954. Arch Biochem Biophys. 53: 311-3. PMID: 13208306
- Complesso EDTA-bismuto. | SAPEIKA, N. 1955. S Afr Med J. 29: 137-9. PMID: 14358876
- L'inibizione dell'azione ematopoietica del cobalto da parte dell'acido etilendiamino. tetraacetico (EDTA). | CHILD, GP. 1951. Science. 114: 466-7. PMID: 14892768
- Il footprinting delle RNasi per mappare i siti delle interazioni RNA-proteine. | Nilsen, TW. 2014. Cold Spring Harb Protoc. 2014: 677-82. PMID: 24890210
- La necroptosi media gli effetti antineoplastici della frazione solubile del polisaccaride del vino rosso in ratti portatori del tumore Walker-256. | Stipp, MC., et al. 2017. Carbohydr Polym. 160: 123-133. PMID: 28115086
- Legame chelante stabile per l'immobilizzazione reversibile di proteine marcate con oligohistidina nel rivelatore a risonanza plasmonica di superficie BIAcore. | Gershon, PD. and Khilko, S. 1995. J Immunol Methods. 183: 65-76. PMID: 7602140
- Determinazione dell'EDTA nel sangue. | Sheppard, RL. and Henion, J. 1997. Anal Chem. 69: 477A-480A. PMID: 9253241
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
EDTA, 0.5 M, pH 8.0, 100 ml | sc-203932 | 100 ml | $20.00 |
