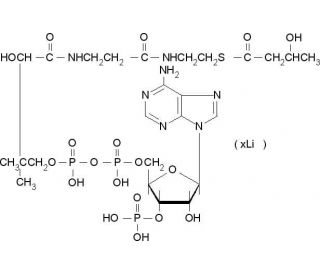
DL-β-Hydroxybutyryl coenzyme A lithium salt (CAS 103404-51-9)
Vedere citazioni di prodotto (1)
LINK RAPIDI
Il sale di litio del DL-β-idrossibutirrato coenzima A funge da materiale di partenza fondamentale per la sintesi dei poliidrossialcanoati batterici (PHB) attraverso l'azione delle sintasi del poliidrossibutirrato (PHB). Questo composto svolge un ruolo nel contesto più ampio della biosintesi microbica e della produzione di polimeri biodegradabili, evidenziando la sua importanza nella ricerca biotecnologica finalizzata allo sviluppo di materiali sostenibili. Il suo coinvolgimento nel metabolismo degli acidi grassi e nella generazione di energia sottolinea la sua importanza fondamentale nei percorsi biochimici che sono centrali nei processi cellulari. Come tale, il sale di litio del DL-β-idrossibutirrato coenzima A non solo è essenziale per la sintesi del PHB, un biopolimero interessante per le sue proprietà biodegradabili, ma rappresenta anche un nodo chiave nelle reti metaboliche che facilitano la conversione dei substrati lipidici in prodotti biotecnologici di valore, offrendo così spunti per l'ottimizzazione delle strategie di ingegneria metabolica per migliorare l'efficienza della biosintesi.
DL-β-Hydroxybutyryl coenzyme A lithium salt (CAS 103404-51-9) Referenze
- Rilevazione dell'attività della poliidrossialcanoato sintasi su un gel di poliacrilammide. | Sheu, DS., et al. 2009. Anal Biochem. 393: 62-6. PMID: 19527674
- Individuazione di intermedi covalenti e non covalenti nella reazione di polimerizzazione catalizzata da una poliidrossibutirrato sintasi di classe III C149S. | Li, P., et al. 2009. Biochemistry. 48: 9202-11. PMID: 19711985
- Caratterizzazione della poliidrossialcanoato sintasi altamente attiva di Chromobacterium sp. ceppo USM2. | Bhubalan, K., et al. 2011. Appl Environ Microbiol. 77: 2926-33. PMID: 21398494
- Analisi basata su LC-MS/MS del coenzima A e dei tioesteri dell'acil-coenzima A a catena corta. | Neubauer, S., et al. 2015. Anal Bioanal Chem. 407: 6681-8. PMID: 26168961
- Svelare e ingegnerizzare la produzione di steroidi 23,24-bisnorcolenici nel metabolismo degli steroli. | Xu, LQ., et al. 2016. Sci Rep. 6: 21928. PMID: 26898409
- Produzione di poliidrossialcanoati (PHA) da rifiuti sintetici con Pseudomonas pseudoflava: Analisi dell'attività enzimatica della PHA sintasi da P. pseudoflava e P. palleronii. | Venkateswar Reddy, M., et al. 2017. Bioresour Technol. 234: 99-105. PMID: 28319778
- Ottimizzazione della sovraespressione di una proteina chaperone della steroide C25 deidrogenasi per la caratterizzazione biochimica e biofisica. | Niedzialkowska, E., et al. 2017. Protein Expr Purif. 134: 47-62. PMID: 28343996
- Analisi in cromatografia liquida a interazione idrofila con spettrometria di massa tandem del malonil-coenzima A in colture di cellule di cancro al seno applicando l'estrazione in fase solida online. | Schriewer, A., et al. 2017. J Sep Sci. 40: 4303-4310. PMID: 28877409
- Caratterizzazione funzionale di un nuovo gene, Hc-dhs-28, e suo ruolo nella protezione dell'ospite dopo l'infezione da Haemonchus contortus attraverso la regolazione della formazione della diapausa. | Yang, Y., et al. 2020. Int J Parasitol. 50: 945-957. PMID: 32858035
- L'istone deacetilasi 3 accoppia i mitocondri per guidare l'infiammazione dipendente dall'IL-1β configurando l'ossidazione degli acidi grassi. | Chi, Z., et al. 2020. Mol Cell. 80: 43-58.e7. PMID: 32937100
- L'impatto della chetogenesi sul metabolismo epatico rivelato dalla proteomica della β-idrossibutirrificazione della lisina. | Koronowski, KB., et al. 2021. Cell Rep. 36: 109487. PMID: 34348140
- L'analisi quantitativa degli acil-CoA subcellulari rivela un metabolismo nucleare distinto e una propionilazione degli istoni dipendente dall'isoleucina. | Trefely, S., et al. 2022. Mol Cell. 82: 447-462.e6. PMID: 34856123
- Il β-idrossibutirrato riduce il ripristino della preferenza di luogo condizionata alla cocaina attraverso la CaMKII-α β-idrossibutirrificazione ippocampale. | Li, H., et al. 2022. Cell Rep. 41: 111724. PMID: 36450263
- Un metodo citochimico quantitativo per la misurazione dell'attività della beta-idrossiacil CoA deidrogenasi nel muscolo cardiaco di ratto. | Chambers, DJ., et al. 1982. Histochemistry. 75: 67-76. PMID: 7118583
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
DL-β-Hydroxybutyryl coenzyme A lithium salt, 10 mg | sc-214926 | 10 mg | $410.00 | |||
DL-β-Hydroxybutyryl coenzyme A lithium salt, 25 mg | sc-214926A | 25 mg | $890.00 | |||
DL-β-Hydroxybutyryl coenzyme A lithium salt, 50 mg | sc-214926B | 50 mg | $1795.00 |
