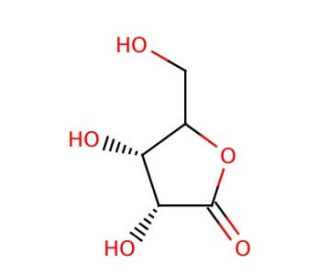
D-Ribonolactone (CAS 5336-08-3)
LINK RAPIDI
Il D-Ribonolattone, uno zucchero lattone ciclico derivato dal ribosio, è emerso come una molecola cruciale in diversi ambiti di ricerca, in particolare nei campi della biochimica, dell'enzimologia e della sintesi organica. La sua struttura chimica, caratterizzata da un anello lattonico a cinque membrane, la rende favorevole allo studio della chimica dei carboidrati e delle trasformazioni enzimatiche. Nella ricerca, il D-Ribonolattone serve come substrato per enzimi come le lattonasi e gli enzimi lattonizzanti, che ne catalizzano l'idrolisi per formare il D-ribosio, una molecola di zucchero fondamentale coinvolta in numerosi processi biologici. Questo meccanismo di idrolisi enzimatica è stato ampiamente studiato per comprendere le interazioni enzima-substrato, i meccanismi catalitici e la specificità del substrato, fornendo approfondimenti sulla cinetica enzimatica e sulle strategie di ingegneria proteica. Inoltre, il D-Ribonolattone è impiegato come precursore nella sintesi di composti contenenti ribosio, tra cui nucleosidi, nucleotidi e derivati di carboidrati, facilitando lo sviluppo di nuove biomolecole con potenziali applicazioni nella scoperta di farmaci, nella biologia molecolare e nella ricerca in biologia chimica. Il suo ruolo versatile come materiale di partenza nella sintesi organica consente la costruzione di diverse librerie chimiche e sonde molecolari per lo studio dei sistemi biologici e lo sviluppo di agenti. Nel complesso, il D-Ribonolattone continua a essere uno strumento prezioso per la ricerca scientifica, contribuendo ai progressi della chimica dei carboidrati, dell'enzimologia e della biologia sintetica.
D-Ribonolactone (CAS 5336-08-3) Referenze
- Scoperta di una piccola molecola insulino-mimetica con attività antidiabetica nei topi. | Zhang, B., et al. 1999. Science. 284: 974-7. PMID: 10320380
- Breve sintesi di 1,2:4,5-diepossipentano enantiopuro C2-simmetrico e di 3-azido-1,2:4,5-diepossipentano 'pseudo'-C2-simmetrico dall'arabitolo. | Boydell, AJ., et al. 2003. J Org Chem. 68: 8252-5. PMID: 14535812
- Compensazione degli effetti della matrice nell'analisi gascromatografica-spettrometria di massa di 186 pesticidi in matrici di tè mediante l'uso di protettori dell'analita. | Li, Y., et al. 2012. J Chromatogr A. 1266: 131-42. PMID: 23102633
- Nucleosidi. CXLVIII. Sintesi della 6-(beta-D-ribofuranosil)picolinamide. Un nuovo nucleoside C dal D-ribonolattone. | Kabat, MM., et al. 1988. Chem Pharm Bull (Tokyo). 36: 634-40. PMID: 3136937
- Un'analisi completa di 201 pesticidi per diverse specie di erbe, pronta per l'applicazione, utilizzando la gas cromatografia-tandem spettrometria di massa accoppiata con QuEChERs. | Fu, Y., et al. 2019. J Chromatogr B Analyt Technol Biomed Life Sci. 1125: 121730. PMID: 31374421
- Iniezione a sandwich e protettori dell'analita come metodo per diminuire la deriva dovuta all'effetto matrice tra le calibrazioni di bracketing in GC-MS/MS: un caso di studio. | Soliman, M. 2021. Talanta. 225: 121970. PMID: 33592804
- Sintesi verde di 1,5-didossi-1,5-imino-ribitolo e 1,5-didossi-1,5-imino-DL-arabinitolo da zuccheri D naturali su catalizzatori Au/Al2O3 e SO42-/Al2O3. | Gao, H. and Fan, A. 2021. Sci Rep. 11: 16928. PMID: 34413372
- Un ingresso facile e generale ai feromoni e agli aromi otticamente attivi con strutture di γ-alchil-γ-lattone. Uno studio su alcuni derivati lattonici dei pentosi† | and J. Cardellach, J. Font, R. M. Ortuño.: March/April 1984. Journal of heterocyclic chemistry. Volume21, Issue2: Pages 327-331.
- Sintesi stereocontrollata di 6-epi-trehazolina e 6-epi-trealamina da D-ribonolattone | Masao Shiozaki, Masami Arai, Yoshiyuki Kobayashi, Atsushi Kasuya, Shuichi Miyamoto, Youji Furukawa, Tomoko Takayama, and Hideyuki Haruyama. 1994. J. Org. Chem. 59: 4450-4460.
- Sintesi concisa, efficiente e su scala di produzione di un derivato protetto del L-LixonolattoneDerivato del L-Lixonolattone: Un importante nucleo di aldonolattone | Hitesh Batra, Robert M. Moriarty, Raju Penmasta, Vijay Sharma, Gabriela Stanciuc, James P. Staszewski, and Sudersan M. Tuladhar, and David A. Walsh. 2006. Organic Process Research & Development. 10: 484−486.
- Sintesi efficiente e altamente stereocontrollata di α- e β-pseudouridine | Stephen Hanessian* and Roger Machaalan. 3 November 2003. Tetrahedron Letters Issue 45. Volume 44: Pages 8321-8323.
- Un approccio basato sul ribonolattone per la sintesi di ribonucleosidi timinici sostituiti con 1′carbonio | Hiroyuki Hayakawa, et al. 1994 - Issue 1-3. Nucleosides and Nucleotides. Volume 13,: 297-308.
- Sintesi di zuccheri dal D-Ribonolattone. II. Una sintesi alternativa del D-eritrosio | Ramesh H. Shah. Received 09 Sep 1985, Accepted 06 Dec 1985, Published online: 21 May 2008. Journal of Carbohydrate Chemistry. Volume 5, 1986 - Issue 1: Pages 139-146.
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
D-Ribonolactone, 5 g | sc-221517 | 5 g | $169.00 |
