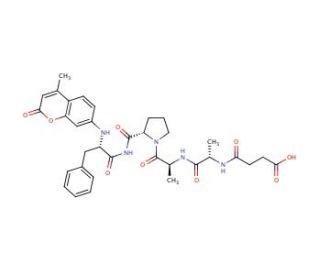
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2)
LINK RAPIDI
Il substrato II della chimotripsina, fluorogenico, è un peptide appositamente studiato che funge da substrato per l'enzima chimotripsina, una proteasi digestiva che scinde i legami peptidici sul lato carbossilico di aminoacidi aromatici come tirosina, triptofano e fenilalanina. L'aspetto fluorogenico di questo substrato significa che, al momento della scissione enzimatica da parte della chimotripsina, rilascia un segnale fluorescente che consente di monitorare in tempo reale l'attività dell'enzima. Questa proprietà lo rende uno strumento prezioso in varie applicazioni analitiche e di ricerca, in particolare nello studio dell'attività delle proteasi e nello screening degli inibitori. Misurando l'aumento dell'intensità della fluorescenza durante la scissione del substrato, i ricercatori possono determinare la velocità dell'enzima, l'affinità con il substrato (Km) e l'efficienza catalitica (kcat), fornendo indicazioni sul suo meccanismo catalitico.
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2) Referenze
- Prove che la ciclofilina-A protegge le cellule dallo stress ossidativo. | Doyle, V., et al. 1999. Biochem J. 341 (Pt 1): 127-32. PMID: 10377253
- La ciclofilina-A è coinvolta nell'attivazione delle caspasi indotta dalle eccitotossine nelle cellule neuronali B50 di ratto. | Capano, M., et al. 2002. Biochem J. 363: 29-36. PMID: 11903043
- Sviluppo di saggi di proteasi basati su plasma accoppiato induttivamente e spettrometria di massa. | Lathia, US., et al. 2010. Anal Biochem. 398: 93-8. PMID: 19912984
- Espressione funzionale di un nuovo inibitore della proteasi di tipo Kunitz del parassita del sangue umano Schistosoma mansoni. | Ranasinghe, SL., et al. 2015. Parasit Vectors. 8: 408. PMID: 26238343
- Clonazione e caratterizzazione di due potenti inibitori della proteasi di Kunitz da Echinococcus granulosus. | Ranasinghe, SL., et al. 2015. PLoS Negl Trop Dis. 9: e0004268. PMID: 26645974
- Attività sinergica tra due proteine antifungine, la defensina vegetale NaD1 e l'inibitore della tripsina pancreatica bovina. | Bleackley, MR., et al. 2017. mSphere. 2: PMID: 29062897
- Strutture cristalline del complesso di un inibitore della callicreina da Bauhinia bauhinioides con la tripsina e modellazione dei complessi della callicreina. | Li, M., et al. 2019. Acta Crystallogr D Struct Biol. 75: 56-69. PMID: 30644845
- L'assorbimento della chimasi da parte dei cardiomiociti determina la degradazione della miosina nel sovraccarico di volume cardiaco. | Powell, PC., et al. 2019. Heliyon. 5: e01397. PMID: 30997426
- L'inibizione della catepsina G da parte di Serpinb1 e Serpinb6 previene la necrosi programmata nei neutrofili e nei monociti e riduce l'infiammazione causata dalla GSDMD. | Burgener, SS., et al. 2019. Cell Rep. 27: 3646-3656.e5. PMID: 31216481
- Screening e identificazione di inibitori della metacaspasi: Valutazione del meccanismo di inibizione e dell'attività tripanocida. | Pérez, B., et al. 2021. Antimicrob Agents Chemother. 65: PMID: 33318019
- Inibitori reversibili fotoswittabili generano ultrasensibilità nelle reazioni enzimatiche fuori equilibrio. | Teders, M., et al. 2021. J Am Chem Soc. 143: 5709-5716. PMID: 33844531
- Scissione proteolitica di peptidi bioattivi e di recettori attivati da proteasi nella colite acuta e post-colite. | De Bruyn, M., et al. 2021. Int J Mol Sci. 22: PMID: 34639054
- Effetto degli inibitori della serina proteasi sul dolore viscerale in diversi modelli di roditori con insulto intestinale. | Ceuleers, H., et al. 2022. Front Pharmacol. 13: 765744. PMID: 35721192
- Attività enzimatiche extracellulari di ceppi di funghi pelagici oceanici e influenza della temperatura. | Salazar Alekseyeva, K., et al. 2022. J Fungi (Basel). 8: PMID: 35736054
- Scoperta e basi molecolari degli inibitori sottotipo-selettivi della ciclofilina. | Peterson, AA., et al. 2022. Nat Chem Biol. 18: 1184-1195. PMID: 36163383
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
Chymotrypsin Substrate II, Fluorogenic, 25 mg | sc-391097 | 25 mg | $193.00 |
