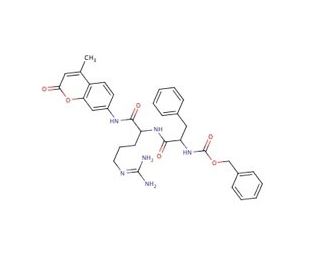
Cathepsin L substrate Substrato (CAS 65147-22-0)
Vedere citazioni di prodotto (11)
LINK RAPIDI
Il substrato della catepsina L è una molecola specializzata progettata per essere utilizzata in saggi biochimici per studiare l'attività proteolitica della catepsina L, un enzima coinvolto nei processi di degradazione delle proteine. Nella ricerca, questi substrati sono fondamentali per chiarire i meccanismi di degradazione e turnover lisosomiale e per comprendere la specificità e la cinetica dell'enzima. Gli scienziati utilizzano substrati marcati in modo fluorescente o cromogenico per monitorare l'attività della catepsina L in tempo reale, fornendo approfondimenti sul ruolo di questo enzima nelle normali funzioni cellulari e nelle condizioni patologiche associate alla sua disregolazione. Inoltre, questi substrati sono in fase di screening di potenziali inibitori in grado di modulare l'attività della catepsina L, un'area di interesse per lo sviluppo di sonde chimiche utilizzate per analizzare complesse vie biologiche. La progettazione e la sintesi di tali substrati spesso incorporano sequenze peptidiche riconosciute e scisse dalla catepsina L, consentendo ai ricercatori di studiare l'impatto delle modifiche post-traduzionali e il comportamento dell'enzima in varie condizioni sperimentali.
Cathepsin L substrate Substrato (CAS 65147-22-0) Referenze
- L'attività della catepsina S è rilevabile nei cheratinociti umani ed è selettivamente upregolata in seguito a stimolazione con interferone-gamma. | Schwarz, G., et al. 2002. J Invest Dermatol. 119: 44-9. PMID: 12164923
- Caratterizzazione di HC58cDNA, una proteasi cisteinica putativa del parassita Haemonchus contortus. | Muleke, CI., et al. 2006. J Vet Sci. 7: 249-55. PMID: 16871019
- Attività di cisteina proteasi simili alla catepsina B e L durante lo sviluppo in vitro di Hysterothylacium aduncum (Nematoda: Anisakidae), un parassita ittico mondiale. | Malagón, D., et al. 2010. Parasitol Int. 59: 89-92. PMID: 19932193
- L'attività di endoproteasi cisteinica della proteina ribosomiale S4 umana è interamente dovuta al dominio C-terminale ed è coerente con il meccanismo di Michaelis-Menten. | Sudhamalla, B., et al. 2013. Biochim Biophys Acta. 1830: 5342-9. PMID: 23791938
- L'apolipoproteina B-100 delle lipoproteine plasmatiche a bassa densità subisce la proteolisi da parte dei fattori di attivazione del contatto quando il plasma viene trattato con destrano solfato-500-MgCl2. | Byrne, RE. and Scanu, AM. 1989. J Lipid Res. 30: 109-20. PMID: 2465366
- Identificazione della catepsina B di una grossa corvina (Pseudosciaena crocea) e del suo ruolo nell'elaborazione della catena invariante associata all'MHC di classe II. | Li, M., et al. 2014. Dev Comp Immunol. 45: 313-20. PMID: 24705226
- Aumento dell'espressione e dell'attività enzimatica della cisteina proteinasi B durante la differenziazione in vitro di Leishmania (Viannia) braziliensis: Prima evidenza di modulazione durante la transizione morfologica. | Gomes, CB., et al. 2017. Biochimie. 133: 28-36. PMID: 27919786
- Identificazione e caratteristiche di una cisteina proteasi simile alla catepsina L di Clonorchis sinensis. | Ma, C., et al. 2019. Parasitol Res. 118: 829-835. PMID: 30689051
- La scissione differenziale di substrati specifici per l'attività della catepsina mostra attività di cisteina e serina proteasi e un profilo differenziale tra Anisakis simplex s.s. e Anisakis pegreffii, specie sorelle che costituiscono i principali agenti eziologici dell'anisakiasi. | Torralbo-Ramírez, V., et al. 2019. Foodborne Pathog Dis. 16: 744-751. PMID: 31215796
- Profili di serina proteasi di isolati clinici di Leishmania (Viannia) braziliensis con diversa sensibilità all'antimonio. | Zabala-Peñafiel, A., et al. 2021. Sci Rep. 11: 14234. PMID: 34244581
- Il fattore di traffico degli enzimi lisosomiali LYSET consente l'utilizzo nutrizionale delle proteine extracellulari. | Pechincha, C., et al. 2022. Science. 378: eabn5637. PMID: 36074822
- Secrezione di cisteina proteinasi da parte dell'anchilostoma zoonotico Ancylostoma caninum. | Dowd, AJ., et al. 1994. Am J Trop Med Hyg. 51: 341-7. PMID: 7943555
- Catepsina B di Schistosoma mansoni. Purificazione e attivazione del proenzima ricombinante secreto da Saccharomyces cerevisiae. | Lipps, G., et al. 1996. J Biol Chem. 271: 1717-25. PMID: 8576174
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
Cathepsin L substrate, 5 mg | sc-3136A | 5 mg | $102.00 | |||
Cathepsin L substrate, 25 mg | sc-3136 | 25 mg | $265.00 | |||
Cathepsin L substrate, 100 mg | sc-3136B | 100 mg | $708.00 |
